
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是
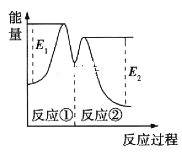
A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如右图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。

pH =4.5(其他条件相同)
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池总反应为4Al+3O2+6H2O=4Al(OH)3。下列说法不正确的是( )
A.正极的电极反应为O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大其与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从薄荷油中得到一种烃A(C10H16),叫α非兰烃,与A相关反应如下:

已知: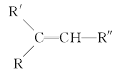
![]()

(1)B所含官能团的名称为____________。
(2)含两个—COOCH3基团的C的同分异构体共有________种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的同分异构体的结构简式为______________。
(3)B→D,D→E的反应类型分别为______________、____________。
(4)G为含六元环的化合物,写出其结构简式:______________。
(5)F在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为___________。
(6)写出E→F的化学反应方程式:___________________________________。
(7)A的结构简式为____________,A与等物质的量的Br2进行加成反应的产物共有________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列关亍电解质的说法中正确的是
A. 中和等体积、等浓度的氨水和氢氧化钠溶液至pH等于7,前者消耗的盐酸多
B. 向NaHS 溶液中加入适量 KOH 后:c(Na+)=c(H2S)+c(HS-)+c(S2-)
C. 将amol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),醋酸的电离常数Ka=![]() (用含a的代数式表示)
(用含a的代数式表示)
D. 向NH4Cl溶液中加入少量等浓度的稀盐酸,则 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Al条插入6 mol·L-1盐酸中,反应过程中产生H2速率变化情况如图1所示。下列说法错误的是
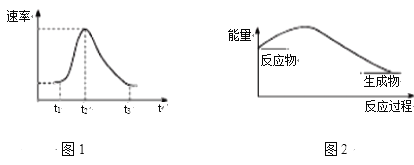
A. 图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B. 图1中影响t1~t2段速率变化的主要原因是反应放热导致溶液温度升高
C. 图1中影响t2~t3速率变化的主要因素是c(Cl-)
D. 图2可以表示该反应过程的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池,如图所示,该电池可将可乐(pH=2.5)中的葡萄糖作为燃料产生能量。下列说法正确的是( )
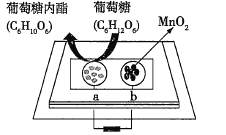
A.a极为正极
B.随着反应的进行,负极区的pH不断增大
C.消耗0.1mol葡萄糖,电路中转移0.2mol电子
D.b极的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为Fe2O3和CuO的混合物且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
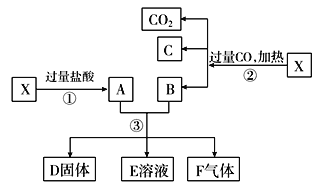
(1)写出步骤③可能发生反应的离子方程式:________________________(共有3个,任写一个即可)。
(2)若溶液E中只有一种金属离子,则一定是__________;若溶液E中含有两种金属离子,则一定是________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:甲:![]() 乙:
乙:![]() 其中能表明甲、乙容器中反应都达到平衡状态的是
其中能表明甲、乙容器中反应都达到平衡状态的是
A. 恒温时,气体压强不再改变
B. 断裂氢氧键速率是断裂氢氢键速率的2倍
C. 混合气体密度不变
D. 单位时间内,消耗水蒸气质量与生产氢气质量比为9:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com