
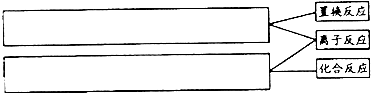
| ① |
| 过量稀硫酸 |
| ②操作a |
| ③双氧水 |
| H+ |
| ④氨水 |
| 操作b |
| ⑤灼烧 |
| ||
 ;
; 

 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
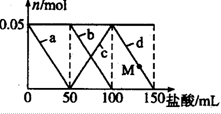 向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )| A、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)2↓ |
| B、b和c曲线表示的离子反应是相同的 |
| C、原混合溶液中CO32-与Al2-的物质的量之比为1:1 |
| D、M点时,溶液中沉淀的质量为3.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:
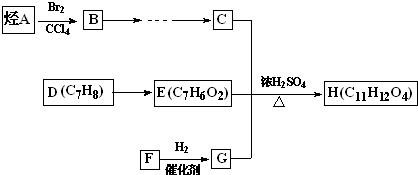
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用润湿的pH试纸测定饱和Na2CO3溶液的pH |
| B、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
| C、将1mLKSCN溶液与1mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深.证明溶液中存在平衡:Fe3++3SCN-═Fe(SCN)3 |
| D、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为终点温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、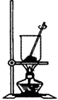 将海带灼烧成灰 |
B、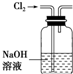 除去Cl2中混有的HCl气体 |
C、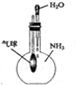 验证NH3易溶于水 |
D、 蒸干NH4Cl饱和溶液制备NH4Cl 晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
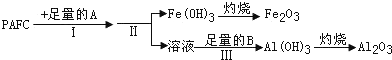
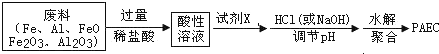
查看答案和解析>>
科目:高中化学 来源: 题型:
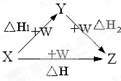
| A、C、CO |
| B、AlCl3、Al(OH)3 |
| C、Fe、Fe(NO3)2 |
| D、S、SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com