
【题目】有人研究了340 K时N2O5的分解反应:2N2O5(g)===4NO2(g)+O2(g),得到不同物质在不同时刻的浓度,见下表。
t/min | 0 | 1 | 2 | 3 | 4 |
c(N2O5)/mol·L-1 | 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
c(O2)/mol·L-1 | 0 | 0.023 | 0.040 | 0.052 | 0.060 |
(1)图像能够非常直观地描述物理量的变化趋势。请你在下图中作出c(NO2)t图像。_________

(2)数据处理是化学实验过程中非常重要的一个环节。请计算3~4min时v(N2O5)=______________。
(3)各物质的化学反应速率之间的关系:________________。
(4)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。应该测定的实验数据是___________________________________。

(5)利用所学的知识,描述升温到800 K时N2O5的分解速率加快的原因____________。
【答案】 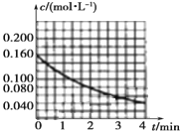 v(N2O5)=0.16/mol·L-1·min-1 反应速率比等于各物质的化学计量数之比 单位时间内收集到的气体的体积或收集相同体积气体时所需要的时间 升高温度活化分子百分数增多,有效碰撞次数增多,反应速率加快
v(N2O5)=0.16/mol·L-1·min-1 反应速率比等于各物质的化学计量数之比 单位时间内收集到的气体的体积或收集相同体积气体时所需要的时间 升高温度活化分子百分数增多,有效碰撞次数增多,反应速率加快
【解析】(1)依据题给数据在坐标系内描点作图,得到c(NO2)t图像为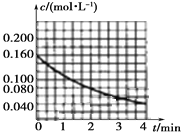 ,故答案为:
,故答案为: ;
;
(2)t4-t3:v(N2O5)= ![]() =0.016 molL-1min,故答案为:0.016 molL-1min;
=0.016 molL-1min,故答案为:0.016 molL-1min;
(3)在化学方程式中,各物质的化学反应速率之比等于各物质的化学计量数之比,故答案为:反应速率之比等于各物质的化学计量数之比;
(4)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置进行定量实验,根据实验要求需要测定一定时间产生气体的体积或测定产生一定体积的气体所需时间,故答案为:测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(5)升高温度活化分子百分数增多,有效碰撞次数增多,反应速率加快,因此升温到800 K时N2O5的分解速率加快,故答案为:升高温度活化分子百分数增多,有效碰撞次数增多,反应速率加快。


科目:高中化学 来源: 题型:
【题目】下列有关乙醇的说法正确的是( )
A. 能与H2O发生加成反应 B. 能使石蕊试液变红
C. 是食醋的主要成分 D. 与CH3OCH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的铜镁合金完全溶于一定体积的浓硝酸中,产生4480mL的NO2和1120mL的NO气体(标准状况下),在反应后的溶液中加足量的氢氧化钠溶液,生成的沉淀的质量可能为 ( )
A. 16g B. 18g C. 20g D. 22g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)周期表中第三周期第VA族元素是(填元素符号).
(2)写出表示含有8个质子,10个中子的原子的化学符号: .
(3)某简单微粒的结构示意图为 ![]() 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题:
①若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是
②若该微粒为一价阳离子,且对应的碱为易溶性强碱,则x= , y=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示: 
①该反应的化学方程式是 .
②反应起始至t,Y的平均反应速率是 .
③关于该反应的说法正确的是 .
A.到达t时刻该反应已停止;
B.在t时刻之前X的消耗速率大于它的生成速率;
C.在t时刻Y的正反应速率等于逆反应速率;
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,在一定条件下既能进行加成反应,也能进行取代反应,并且不能使KMnO4酸性溶液褪色的是( )
A. 乙烷 B. 苯 C. 乙醇 D. 乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com