
【题目】关于下列电解质溶液的说法中,正确的是
A.常温下,![]() 与
与![]() 两溶液混合后
两溶液混合后![]() ,则一定有
,则一定有![]()
B.常温下,![]() 溶液与
溶液与![]() 溶液混合后所得
溶液混合后所得![]() 的溶液中:
的溶液中:![]()
C.![]() 溶液中离子总数为x,
溶液中离子总数为x,![]() 溶液中离子总数为y,则
溶液中离子总数为y,则![]()
D.已知:![]() 的
的![]() 为
为![]() ,若将浓度均为
,若将浓度均为![]() 的
的![]() 溶液和KOH溶液等体积混合,则会有
溶液和KOH溶液等体积混合,则会有![]() 沉淀产生
沉淀产生
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g) ![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A.该反应的平衡常数表达式为K=![]()
B.平衡时c(CH3OH)=0.04 mol·L-1
C.该时刻正、逆反应速率的大小:v正<v逆
D.若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶的液体时,取下瓶塞倒立放桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子 ⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
A.①④⑦⑩B.②③④⑩C.⑤⑥⑦⑧D.①②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c,d均是热和电的良导体。下列说法不正确的是
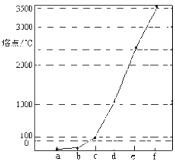
A.e、f单质晶体熔化时克服的是共价键
B.d单质对应元素原子的电子排布式:1s22s22p63s23p2
C.b元素形成的气态氢化物易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬![]() 和
和![]() 废水常用方法,过程如下:CrO42-
废水常用方法,过程如下:CrO42-![]()
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3 ,已知废水中Cr的含量为
Cr(OH)3 ,已知废水中Cr的含量为![]() ,当溶液中离子浓度小于
,当溶液中离子浓度小于![]() 时认为离子已经沉淀完全,常温下,
时认为离子已经沉淀完全,常温下,![]() 有关叙述中不正确的是
有关叙述中不正确的是
A.上述三个转化中只有一个涉及氧化还原反应
B.第二步离子方程式为:![]()
C.处理含铬废水可使用强碱![]() ,也可以使用弱碱氨水
,也可以使用弱碱氨水
D.当![]() 时,废水中铬元素沉淀完全
时,废水中铬元素沉淀完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:FeO(s)+CO(g) = Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将 | 先无现象后产生白色胶状沉淀 |
|
B | 向2支盛有醋酸和硼酸溶液的管中分别滴加 | 醋酸:产生气泡; 硼酸:无现象 |
|
C | 将少量 | 沉淀由红褐色变为白色 |
|
D | 溴乙烷、乙醇及固体NaOH混合加热,产生的气态物质通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 溴乙烷发生消去反应生成了乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋![]() 主要成分是
主要成分是![]() 的总酸量
的总酸量![]() 。已知
。已知![]() 终点时所得溶液呈碱性。
终点时所得溶液呈碱性。
Ⅰ、实验步骤:
(1)用移液管量取![]() 食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液![]() 于锥形瓶中。
于锥形瓶中。
(3)滴加2滴_____________作指示剂。
(4)读取盛装![]() 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 ________mL。
溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 ________mL。

(5)滴定,当______________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。Ⅱ![]() 实验记录
实验记录

Ⅲ、数据处理与讨论:
(1)根据上述数据分析得![]() 市售白醋
市售白醋![]() ________
________![]() 。
。
(2)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______![]() 填写序号
填写序号![]() 。
。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
E. 滴定终点读数时俯视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com