
| 6+2 |
| 2 |
| 1 |
| 4 |


科目:高中化学 来源: 题型:
| A、大理石与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| B、钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu |
| C、铁与稀硫酸的反应:Fe+2H+=Fe2++H2↑ |
| D、Ba(OH)2溶液与H2SO4溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同体积、同密度的CO和CO2气体 |
| B、同温度、同体积的O2和O3气体 |
| C、同压强、同体积的N2O和CO2气体 |
| D、同质量、不同密度的O2和O3 气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D.FeCl3溶液(FeCl2) | 酸性KMnO4溶液 | Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
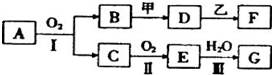
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 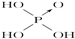 | 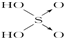 | 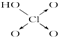 |
| 非羟基 氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
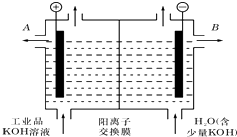 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com