
����Ŀ��ij��ѧ��ȤС��Ϊ̽��SO2�����ʣ�����ͼ��ʾװ�ý���ʵ�顣(��֪��Na2SO3+ H2SO4(Ũ)=Na2SO4+SO2��+H2O)
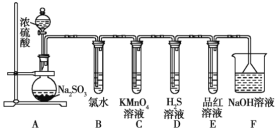
��ش��������⣺
(1)װ��A��ʢ��Ũ����������������������Ʒֱ���______��______��
(2)��Ӧ��װ��B�в�����������______��������Ӧ�����ӷ���ʽΪ______��װ��D�е�������______��������Ӧ�Ļ�ѧ����ʽΪ______��
(3)װ��E��Ŀ����̽��SO2��Ʒ����Һ���õĿ����ԣ�д��ʵ�����������____________��
(4)Fװ�õ�������______������©����������______��
���𰸡���Һ©�� Բ����ƿ ��Һ�Ļ���ɫ��ȥ������Һ��ɫ�� SO2+Cl2+2H2O=4H++SO42-+2Cl- ��Һ�г��ֻ�ɫ���� SO2+2H2S=3S��+2H2O ���Թ�E�ھƾ����ϼ��ȣ���Һ�ָ���ɫ ���ն����SO2 ��ֹ����
��������
A��Ũ�������������Ʒ�Ӧ���ɶ����������壻B�ж�����������ˮ��Ӧ�������ᣬʹ��ˮ��ɫ��C�ж��������������ط�Ӧ��������������̣�ʹ���������Һ��ɫ��D�ж������������ⷴӦ���ɵ����������E����Ʒ�췴Ӧ������ɫ���ʣ�ʹƷ����Һ��ɫ�����������ж���FΪβ������װ�á�
(1)����װ���ص㣬ʢ��Ũ����������������������Ʒֱ��Ƿ�Һ©����Բ����ƿ��
(2)װ��B�У�������������ˮ��Ӧ������������ᣬ������ˮ��Һ��ɫ�����������ӷ���ʽΪSO2+Cl2+2H2O=4H++SO42-+2Cl-��װ��D�ж������������ⷴӦ���ɵ��������������ʽΪSO2+2H2S=3S��+2H2O��
(3)SO2��Ʒ����Һ��Ӧ������ɫ���ʣ��ټ���ʱ����Һ�ָֻ�ԭɫ���������Ϊ���Թ�E�ھƾ����ϼ��ȣ���Һ�ָ���ɫ��
(4)���������ж���FΪβ������װ�ã���������������ˮ�����۵�©���ɷ�ֹ������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij1L������Һ�г�����0.2 mol��L��1��Na���⣬�����ܺ������������е�һ�ֻ���֣�
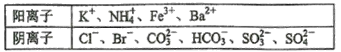
�ֽ�������ʵ�����(ÿ��ʵ�������Լ�������)
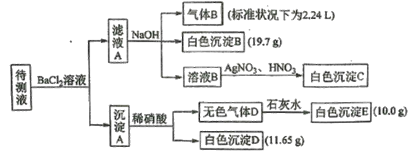
����˵������ȷ����
A.����ҺB�м�AgNO3��HNO3�IJ����Ƕ���ģ�����Һ��һ�����е�������K����NH4����CO32����HCO3������c(K��)��0.1mol��L��1
B.���ɰ�ɫ����B�����ӷ���ʽΪBa2����HCO3����OH����BaCO3����H2O
C.��֪��ɫ����C������Ũ��ˮ�����ӷ���ʽΪAgCl��2NH3��H2O��Ag(NH3)2����Cl����2H2O
D.����ɫ����D�ǻ�����壬�����A�ijɷֿ�����BaCO3��BaSO3��BaSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش�ʵ��������0.1 mol/L��NaOH��Һ500 mLʵ���е��������⡣
��1����NaOH_________g��
��2��������������
���ձ� ��100 mL��Ͳ ��ҩ�� ��500 mL����ƿ �ݽ�ͷ�ι� ��������ƽ������ʱ����ȱ�ٵIJ���������__________________��
��3�����г���NaOH�IJ����У���ȷ����_______________��(����ţ���ͬ)
�ٰ�NaOHֱ�ӷ��������ϳ���
�ڰ�NaOH���ڳ���ֽ�ϳ���
�۰�NaOH�����ձ��г���
��4��ʹ������ƿǰ������е�һ��������_____________________________��
��5�����ƹ����У����в������������ƫ�ߵ���_______________________��
��δϴ���ձ���������
��NaOH��Һδ��ȴ�����¾�ת�Ƶ�����ƿ��
������ƿ�����������������ˮ
�ܳ���NaOH��ʱ��̫��
�ݶ���ʱ���ӿ̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һϵ�к������ת����ϵ����Ӧ�����ɵ�ˮ����ȥ��������˵����ȷ����

A.��Ӧ��˵��SO2����Ư���ԣ���Ӧ��˵��SO2��������
B.��Ӧ����������n��Na2SO3����n��NaHSO3����1��1ʱ����Ӧ��n��SO2����n��NaOH����1��2
C.��Ӧ�ۢܢݾ�����������ԭ��Ӧ
D.��ҵ�Ͽ����÷�Ӧ�ںͷ�Ӧ�ܻ���SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����(����)
A.�������ᷴӦ��2Fe+6H+==2 Fe3++ H2��
B.���Ȼ�����Һ�еμӹ����İ�ˮ��Al3++4 OH���T AlO![]() +2 H2O
+2 H2O
C.���Ȼ�����Һ�м������ۣ�Fe3+��Fe��2Fe2+
D.�Ȼ�����Һ������������Һ��Ӧ��Fe3++3OH���T Fe��OH��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽��Cl2��SO2ͬʱͨ��ˮ���������ķ�Ӧ��ijУ��ѧ��ȤС��ͬѧ�������ͼ��ʾ��ʵ��װ�á�
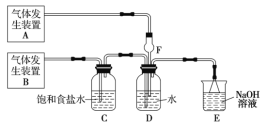
(1)�û�ѧ��ȤС���ͬѧ����Na2SO3����������Ϊ70%������Ϊԭ����ȡSO2������MnO2��Ũ����Ϊԭ����ȡCl2���ڴ�ʵ���У�����![]() ��������______�����巢��װ��BӦѡ������װ���е�____________(�����)��
��������______�����巢��װ��BӦѡ������װ���е�____________(�����)��
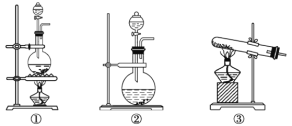
(2)Ϊ��֤ͨ��Dװ���е�������Cl2��������SO2�������û�ѧ��ȤС���ͬѧ���������Լ���
���Ȼ�����Һ ���Ȼ�������Һ �����軯����Һ �����Ը��������Һ
��Cl2������ȡ����D����Һ�μ���ʢ��______(�����)���Թ��У��ټ���______������ţ���������������______��
��SO2������ȡ����D����Һ�μ���ʢ��______(�����)���Թ��У�������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϳɳ�������ӵ�������ԭ�ϴ����ḻ���۸��������ȫ�Ըߵ��ŵ��������������![]() �����۱������ϸߣ���ŵ�����в��Ͻṹ�ȶ���������
�����۱������ϸߣ���ŵ�����в��Ͻṹ�ȶ���������![]() �Ŀ�����Ƕ��������Ϊһ�ַdz���DZ�����������ϣ�����˵������ȷ����
�Ŀ�����Ƕ��������Ϊһ�ַdz���DZ�����������ϣ�����˵������ȷ����
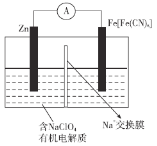
A.�ŵ�ʱ��![]() �ϵĵ��Ʊ�ZnƬ�ϵĸ�
�ϵĵ��Ʊ�ZnƬ�ϵĸ�
B.�ŵ�ʱ��������ӦΪ![]()
C.���ʱ�����·��ͨ��0.2 mol����ʱ��������������6.5 g
D.�����������ϣ�����ʵ��![]() ��Ƕ�룬�ŵ��ʵ��
��Ƕ�룬�ŵ��ʵ��![]() ����Ƕ
����Ƕ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϵ�·���ͭ����FeCl3��Һ���ܽ�����ա��ֽ�һ���·�������100 mLFeCl3��Һ��ʹͭȫ���ܽ�(��·�����������ʾ���������Ӧ)����õ�·������������3.2 g���ڽ���Һ�м�������Fe�۲�ʹ֮��ַ�Ӧ�����˸�����壬���������ȼ����Fe������������2.4g��
����㣺
(1)����Һ�е�������__________(д��ѧʽ) ��
(2)���뷴Ӧ������������__________g��
(3)������Һ��������䣬���������Һ��c(Fe2��)��__________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����Ũ������ľ̿�ڼ��������·�Ӧ����SO2��CO2���壬�������ͼʵ��װ�ã�a��b��cΪֹˮ�У�B�����ڴ��������ң�D�з��������Ը��������Һ��ʪ����֬�ޡ�

��ش��������⣺
(1)ʵ��ǰ����еIJ�����_______________________________
(2)д��Բ����ƿ���������ķ�Ӧ����ʽ____________________________________________
(3)��ʵ��ɰܵĹؼ����ڿ��Ʒ�Ӧ������������ʲ��ܹ��죬�ɴ��������ֵ�װ�ã�����ȷ�IJ���˳����________(�ñ����д)��
����Aװ���м���Ũ���ᣬ���ȣ�ʹA�в����������������B���������г���һ��������ʱ��ֹͣ���ȣ�
�ڴ�װ��A��ȴ��������B��������ٱ仯�ر�ֹˮ��a����ֹˮ��b��������ѹ���ң�ʹ����B��������������װ��C�У����ﵽʵ��Ŀ�ĺر�ֹˮ��b��
�۴�ֹˮ��a��c���ر�ֹˮ��b;
(4)ʵ��ʱ��װ��C�е�����Ϊ______________
(5)��D�в���______(����ĸ��д)����ʱ������˵��ʹE�г���ʯ��ˮ������CO2��������SO2��
A��������һ����֬����ɫ��dz��������һ����֬����ɫ���䡡
B����֬������ɫ����dz C����֬������ɫ��ȥ
��װ��D������Ϊ____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com