
����Ŀ����������ѧ��־�����������³ƣ�һ����̼������Ӧʹ�õĽ��������︴�ϴ��������ȡ���ش��չ��һ����̼������Ӧ����-����ͭ�������ɶ�����̼����ͼ1��ʾ��
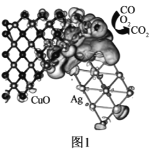
�ش��������⣺
��1��Ag�����ڱ���λ��Cu���ڸ������һ���ڣ��۵�����Ŀ��ͭ��ȫ��ͬ����̬Agԭ�ӵļ۵����Ų�ͼΪ__��
��2��CO��N2��Ϊ�ȵ����壬��CO�ĵ���ʽΪ__��д��һ����CO��Ϊ�ȵ�����������ӵ����ӷ���__��C��N��O����Ԫ���е�һ����������Ϊ__(��Ԫ�ط���)��CO��Ni�ڸ����¿�������Ni(CO)4��Ni(CO)4��Ni��d�����10���ӹ��ͣ���4s�������������Ҳ����3d���������s�����p����γ��ĸ��ӻ�����������ӻ���ʽΪ__�ӻ����ݴ��Ʋ�Ni(CO)4�Ŀռ乹��Ϊ__��Ni��CO֮��Ļ�ѧ��Ϊ__��
��3��һЩ��������۵��������±���ʾ��

����������֮���۵�����ԭ��Ϊ__��
��4���������ľ�����ͼ2��ʾ��
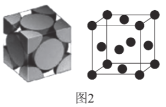
�پ������Ķѻ���ʽΪ__��
����NA��ʾ�����ӵ�������ֵ��Mg��mol-1��ʾ����Ħ��������dcm��ʾ��ԭ�ӵ�ֱ�������������ܶȿɱ�ʾΪ__g��cm-3(�ú�NA��M��d�Ĵ���ʽ��ʾ)��
���𰸡�![]()
![]() CN�� N sp3 �������� ��λ�� CO2��CO�Ƿ��Ӿ��壬CuO��MgO�����Ӿ��壬���Ӿ����۵�С�����Ӿ��壬���Ӿ�������Է�������Խ���»���Խ���۵�Խ�ߣ����Ӿ�����Mg2+�뾶��Cu2+�뾶С��MgO�����̣�MgO�����ܴ��۵�� ��������
CN�� N sp3 �������� ��λ�� CO2��CO�Ƿ��Ӿ��壬CuO��MgO�����Ӿ��壬���Ӿ����۵�С�����Ӿ��壬���Ӿ�������Է�������Խ���»���Խ���۵�Խ�ߣ����Ӿ�����Mg2+�뾶��Cu2+�뾶С��MgO�����̣�MgO�����ܴ��۵�� �������� ![]()
��������
��Ag�����ڱ���λ��Cu���ڸ������һ���ڣ��۵�����Ŀ��ͭ��ȫ��ͬ��Cu�۵���Ϊ3d104s1��
��CO��N2��Ϊ�ȵ����壬N2�ǹ������Ե��ӣ����ݼ۵��ӹ�ϵN����O��ͬ��ͬ���ڵ��������������ƣ�����VA����ڵ�VIA��Ԫ�أ�Ni����s�����p����γ��ĸ��ӻ�����ó��ӻ���ʽ���Ӷ��Ƴ�Ni(CO)4�Ŀռ乹�ͺ�Ni��CO֮��Ļ�ѧ����
�DZ���������֮���۵�����ԭ��ΪCO2��CO�Ƿ��Ӿ��壬CuO��MgO�����Ӿ��壬M�ֱ�����۵��Сԭ��
�Ȣپ��������������ĺͶ����ϣ����ȼ����ⳤ���ټ���һ������������ԭ�Ӹ������ټ��㾧�������ܶȡ�
��Ag�����ڱ���λ��Cu���ڸ������һ���ڣ��۵�����Ŀ��ͭ��ȫ��ͬ��Cu�۵���Ϊ3d104s1����˻�̬Agԭ�ӵļ۵���Ϊ4d105s1����̬Agԭ�ӵļ۵����Ų�ͼΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��CO��N2��Ϊ�ȵ����壬N2�ǹ������Ե��ӣ������CO�ĵ���ʽΪ![]() �����ݼ۵��ӹ�ϵN��=O�������CO��Ϊ�ȵ�����������ӵ����ӷ���CN����ͬ���ڵ��������������ƣ�����VA����ڵ�VIA��Ԫ�أ�C��N��O����Ԫ���е�һ����������ΪN��CO��Ni�ڸ����¿�������Ni(CO)4��Ni(CO)4��Ni��d�����10���ӹ��ͣ���4s�������������Ҳ����3d���������s�����p����γ��ĸ��ӻ�����������ӻ���ʽΪsp3�ӻ����ݴ��Ʋ�Ni(CO)4�Ŀռ乹��Ϊ�������Σ�Ni��CO֮��Ļ�ѧ��Ϊ��λ�����ʴ�Ϊ��
�����ݼ۵��ӹ�ϵN��=O�������CO��Ϊ�ȵ�����������ӵ����ӷ���CN����ͬ���ڵ��������������ƣ�����VA����ڵ�VIA��Ԫ�أ�C��N��O����Ԫ���е�һ����������ΪN��CO��Ni�ڸ����¿�������Ni(CO)4��Ni(CO)4��Ni��d�����10���ӹ��ͣ���4s�������������Ҳ����3d���������s�����p����γ��ĸ��ӻ�����������ӻ���ʽΪsp3�ӻ����ݴ��Ʋ�Ni(CO)4�Ŀռ乹��Ϊ�������Σ�Ni��CO֮��Ļ�ѧ��Ϊ��λ�����ʴ�Ϊ��![]() ��CN����N��sp3���������Σ���λ����
��CN����N��sp3���������������
�DZ���������֮���۵�����ԭ��ΪCO2��CO�Ƿ��Ӿ��壬��Է�������Խ���»���Խ���۵�Խ�ߣ�CuO��MgO�����Ӿ��壬Mg2+�뾶��Cu2+�뾶С��MgO�����̣�MgO�����ܴ��۵�ߣ��ʴ�Ϊ��CO2��CO�Ƿ��Ӿ��壬CuO��MgO�����Ӿ��壬���Ӿ����۵�С�����Ӿ��壬���Ӿ�������Է�������Խ���»���Խ���۵�Խ�ߣ����Ӿ�����Mg2+�뾶��Cu2+�뾶С��MgO�����̣�MgO�����ܴ��۵�ߡ�
�Ȣپ��������������ĺͶ����ϣ�������Ķѻ���ʽΪ�����������ʴ�Ϊ������������
����NA��ʾ�����ӵ�������ֵ��Mg��mol-1��ʾ����Ħ��������dcm��ʾ��ԭ�ӵ�ֱ�������ⳤΪa�����![]() ��
��![]() ��һ������������ԭ�Ӹ���Ϊ
��һ������������ԭ�Ӹ���Ϊ![]() �����������ܶȿɱ�ʾΪ
�����������ܶȿɱ�ʾΪ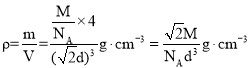 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij��̼���⡢������Ԫ�ص�δ֪��A����ȼ�շ���֪��̼����������Ϊ60%��������������Ϊ26.7%������ʵ��ʽΪ��_______��
��2������A�������ͬ״���µ��������ܶ���30����A�ķ���ʽΪ________�����ܵĽṹʽ��________�֣�
��3��A�ĺ������ͼ�Ϸ�����O��H����C��H����C��O���������գ���A�Ľṹ��ʽ����Ϊ���м���д���֣�________����
��4��A�ĺ˴Ź����������������շ壬�����֮��Ϊ1��1��6����A�������ǡ�________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(![]() )�뱽Ȳ(
)�뱽Ȳ(![]() )��Ӧ���ɻ�����X(����Գ�ͼ��)����ͼ��ʾ��
)��Ӧ���ɻ�����X(����Գ�ͼ��)����ͼ��ʾ��
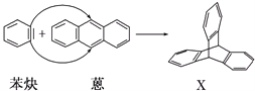
(1)����X������__��
a����������b����������c��������
(2)��Ȳ�ķ���ʽΪ__����Ȳ�����е�������__��
a��������ˮ b���ܷ���������Ӧ c���ܷ����ӳɷ�Ӧ d�����³�ѹ��Ϊ����
(3)�������ڱ���ͬϵ�����__(����ĸ����)��
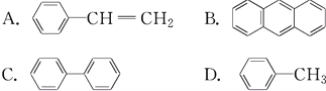
(4)�ܷ����ӳɷ�Ӧ��Ҳ�ܷ���ȡ����Ӧ��ͬʱ��ʹ��ˮ��Ӧ��ɫ��Ҳ��ʹ���Ը��������Һ��ɫ����__��
A.![]() B.C6H14 C.
B.C6H14 C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ձ���ʢ���Ǻ�ˮ,������ʴ�ɿ쵽����˳����( )
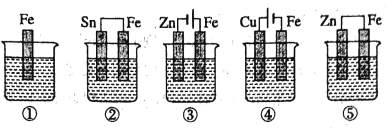
A.��>��>��>��>��B.��>��>��>��>��C.��>��>��>��>��D.��>��>��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��3-����ϩ�ڻ�������Һ�����巢���ӳɷ�Ӧʱ�����������ֲ���M��N(�����������칹)���䷴Ӧ������ͼ1��ʾ�������£�M���Ի���ת��ΪN�������仯��ͼ2��ʾ�����й��ڸù��̵�����������ǣ� ��
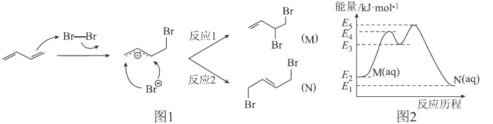
A.�����£�N���ȶ���ǿ��M
B.�л���N����˳���칹
C.�κ�ʱ�����M�IJ���һ������N�IJ���
D.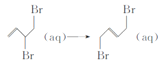 ��H=-(E2-E1)kJ��mol-1
��H=-(E2-E1)kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����Ȼ�ѧ����ʽ�У���ѧ��Ӧ�Ħ�Hǰ�ߴ��ں��ߵ��ǣ�����
��C(s)+O2(g)= CO2(g)��H1��C(s)+ ![]() O2(g)= CO(g)��H2
O2(g)= CO(g)��H2
��S(s)+O2(g)= SO2(g)��H3��S(g)+O2(g)=SO2(g)��H4
��H2(g)+ ![]() O2(g)=H2O(l)��H5��2H2(g)+O2(g)= 2H2O(l)��H6
O2(g)=H2O(l)��H5��2H2(g)+O2(g)= 2H2O(l)��H6
��CaCO3(s)= CaO(s)+CO2(g)��H7��CaO(s)+H2O(l)= Ca(OH)2(s)��H8
A.��B.��C.�ڢۢ�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ������ᶡ��(�׳��Ჴ����)���������������Խ�ĸ��ù���к�ǿ���������ã���ҵ�ϳ��ö��ǻ��������붡����Ũ������½���������Ӧ���Ƶã�������ij�����鿪���Ĵ����ۡ��õĻ���ԭ�ϳ����Ʊ����ǻ������ᶡ���ĺϳ�·�ߣ�
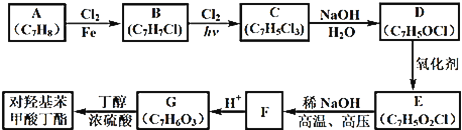
��֪������Ϣ����ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ�����D����������Һ��Ӧ������������F�ĺ˴Ź������ױ����������ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ1�s1���ش��������⣺
(1)A�Ļ�ѧ����Ϊ__��
(2)��B����C�Ļ�ѧ��Ӧ����ʽΪ__���÷�Ӧ������Ϊ__��
(3)D�Ľṹ��ʽΪ__��
(4)F�ķ���ʽΪ__��
(5)G�Ľṹ��ʽΪ__��
(6)E��ͬ���칹���к��б������ܷ���������Ӧ�Ĺ���__�֣����к˴Ź������������ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ2�s2�s1����____________(д�ṹ��ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ�������
A. ��������Һ��ͨ�������Ķ�����̼�������DZ��Ӻ�̼����
B. ����ͬϵ���У������Ͳ����Ӱ�죬ʹ�ö��߾��ױ�����
C. ![]() �ں˴Ź��������г�������壬����ԭ����֮��Ϊ3��2
�ں˴Ź��������г�������壬����ԭ����֮��Ϊ3��2
D. ����ȩ������ϩ�����е�����ԭ�ӿ��ܴ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A��g��+5B��g��![]() 4C��g��+6D��g������5 L���ܱ������н��У�����Ӻ�C�����ʵ���������0.30 mol������������ȷ���ǣ�������
4C��g��+6D��g������5 L���ܱ������н��У�����Ӻ�C�����ʵ���������0.30 mol������������ȷ���ǣ�������
A. A��ƽ����Ӧ������0.010 molL��1s��1
B. �����к�D���ʵ�������Ϊ0.45 mol
C. ������A��B��C��D�����ʵ����ı�һ����4��5��4��6
D. ������A�����ʵ���һ��������0.30 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com