
| A. | 碳的燃烧热110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀醋酸与稀NaOH溶液反应生成1mol H2O时对应的反应热为-57.3 kJ/mol | |
| D. | 稀盐酸与稀NaOH溶液反应生成1mol H2O时对应的反应热为-57.3 kJ/mol |
分析 A.CO燃烧生成二氧化碳继续放出热量;
B.反应热分吸收热量,放出热量;
C.醋酸是弱电解质,电离过程是吸热;
D.根据中和热表述方法分析.
解答 解:A.使用燃烧热时要注意两个关键点:①反应物用量:可燃物为1mol;②产物要求:充分燃烧成稳定氧化物[H→H2O(l)、C→CO2 (g)、S→SO2 (g)],由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以碳的燃烧热大于110.5 kJ/mol,故A错误;
B.①的反应热为-221kJ/mol,故B错误;
C.醋酸的电离过程是吸热的,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3kJ,则反应热大于-57.3 kJ/mol,故C错误;
D.稀盐酸与稀NaOH溶液反应生成1mol H2O时放出的热量为57.3kJ,则反应热为-57.3 kJ/mol,故D正确;
故选D.
点评 本题主要考查学生对于反应热、中和热的理解及有关计算等,题目难度不大,注意中和热表述方法.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
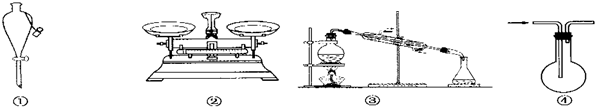
| A. | 仪器①可用于乙醇与水分离提纯 | |
| B. | 仪器②可用于称取5.85 g氯化钠固体 | |
| C. | 装置③的烧瓶中应加沸石,以防暴沸 | |
| D. | 装置④从箭头方向进气,用排空气法可收集H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
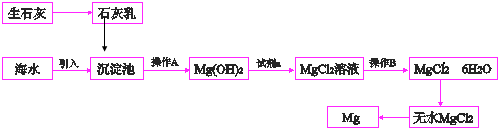
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制操作为:称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| B. | 称量 NaOH固体时,应在托盘天平两盘上各放一张大小相同的纸片 | |
| C. | 若所用NaOH固体中有少量Na2O杂质,则造成所配溶液浓度偏高 | |
| D. | 若用10 mol•L-1NaOH溶液来配制,用量筒量取20 mL NaOH浓溶液倒入烧杯后,应该用同一量筒取一定量蒸馏水倒入烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧是将化学能只转化为热能 | |
| B. | 浓硫酸溶于水发热,所以该反应为放热反应 | |
| C. | 反应物的总能量高于生成物的总能量是放热反应 | |
| D. | 吸热反应是断裂化学键吸收的总能量小于形成化学键放出的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去AlCl3溶液中的FeCl3杂质的方法:先加入足量浓氨水,过滤,再加入过量盐酸,得到纯净AlCl3溶液 | |
| B. | 可以用金属钠和MgCl2溶液反应置换金属Mg;可以通过化合反应制备Fe(OH)3 | |
| C. | 对某溶液进行焰色反应,火焰呈黄色,则证明该溶液中含有钠盐,可能有钾盐 | |
| D. | 配制氯化铁溶液时,将氯化铁固体溶解在较浓的盐酸中再加水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 平衡时,两个容器中NH3的体积分数均为25% | |
| C. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com