
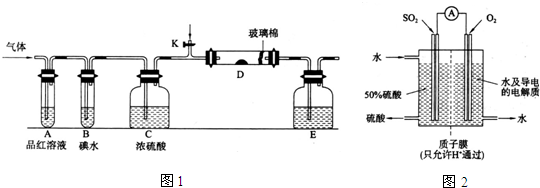
| 催化剂 |
| △ |
| 催化剂 |
| △ |


科目:高中化学 来源: 题型:
A、CO2的电子式 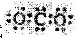 | ||
B、Cl-的结构示意图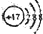 | ||
| C、H216O、D216O、H218O、D216O互为同素异形体 | ||
D、质量数为37的氯原子
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 1 | 2 |
| 步骤 | 滴加3~10滴浓硫酸 | 滴加10~20滴6mol/L氢氧化钠溶液 |
| K2Cr2O7溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
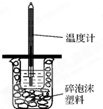 如图所示,50mL0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在装置中进行中和反应.通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
如图所示,50mL0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在装置中进行中和反应.通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题:
原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
A、一定含有I-,一定没有NO
| ||
B、可能含有NO
| ||
C、可能含有NO
| ||
| D、一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 试剂丙 | 甲离子 | 乙离子 |
| A | Ba(NO3)2溶液、稀盐酸 | SO42- | SO32- |
| B | 稀盐酸、品红溶液 | SO32- | CO32- |
| C | 硫氰化钾溶液,氯水 | Fe2+ | Fe3+ |
| D | 稀氨水 | Ag+ | Al3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com