
| A����״���£���1 g��ƬͶ��20 mL 18.4 mol?L-1�������� |
| B����100 mL 3 moI?L-1���������5.6 g�� |
| C����50 mL 18 mol?L-1Ũ����������Cu���ȣ�ָ���е����ᱻ��ȫ���ģ� |
| D����5��107 Pa��500�������ý���������£���3 mol������2 mol�����ϳɰ� |
| 5.6g |
| 56g/mol |
| 5.6g |
| 56g/mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Һ��c��OH-��=10-7 mol/L�������Һһ�������� |
| B��c��H+��Խ����pHԽ����Һ�ļ���Խǿ |
| C��pH=0����Һ������ֻ����H+������OH- |
| D����25�洿ˮ�м�����NaHSO4���¶Ȳ��䣩��c��H+����c��OH-���˻����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ۢ� | B���ۢ� | C���ڢ� | D���٢� |
�鿴�𰸺ͽ���>>
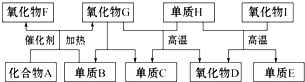
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
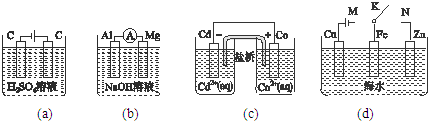
| A��ͼ��a���У����ŵ��Ľ��У���Һ��H+��Ũ��Խ��ԽС |
| B��ͼ��b���У�Mg�缫����صĸ��� |
| C��ͼ��c���У������ķ�ӦΪCo+Cd2+=Cd+Co2+ |
| D��ͼ��d���У�K�ֱ���M��N����ʱ��Fe�缫���ܵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
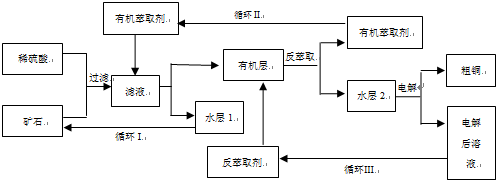
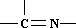 ���ֻ��ţ���״�ṹ����A����Է�������Ϊ116��������������ʱ̼ԭ�Ӹ�̼ԭ����������A�Ľṹ��ʽ��
���ֻ��ţ���״�ṹ����A����Է�������Ϊ116��������������ʱ̼ԭ�Ӹ�̼ԭ����������A�Ľṹ��ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����֪2H2��gO2��g��=2H2O��g������H=-483.6 kJ/mol����������ȼ����Ϊ241.8 kJ/mol |
| B����֪C��ʯī��s��=C�����ʯ��s������H��0������ʯ��ʯī�ȶ� |
| C����20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7 kJ����������÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪ��NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��aq������H=-57.4 kJ/mol |
| D����֪2C��s��+2O2��g��=2CO2��g������H1��2C��s��+O2��g��=2CO��g������H2�����H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���Ȼ�������Һ���������2��1��Ӧ��6Fe2++3 Na2O2+6 H2O=4Fe��OH��3��+6 Na++2Fe3+ |
| B�����������м�������ᷢ����Ӧ��Fe2O3+6H++6 I -=2Fe2++3I2+3H2O |
| C��˫��ˮ����ϡ�����KI��Һ��H2O2+2H++2I-=I2+O2��+2 H2O |
| D����������Һ�м������[Ag��NH3��2]++OH-+3H+=Ag++2NH4++H2O |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com