
| 溶解 |
| ① |
| BaCl2(过量) |
| ② |
| NaOH(过量) |
| ③ |
| Na2CO3(过量) |
| ④ |
| 过滤 |



 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
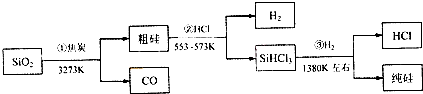
| A、①②③均属于氧化还原反应 |
| B、H2和HCl均可循环利用 |
| C、SiO2是一种坚硬难熔的固体 |
| D、光纤的主要成分是高纯度的单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
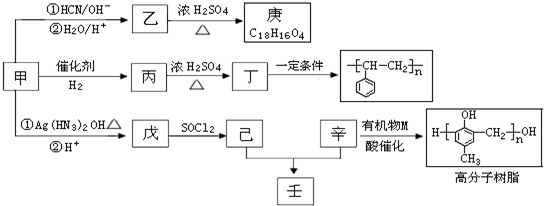
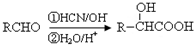
| SOCl2 |
| R′OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液绿色,稀溶液蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
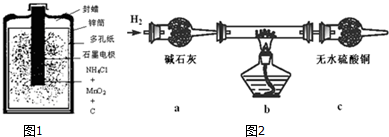
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、容器体积增加可以是向其中充入了惰性气体 |
| D、a<b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com