
【题目】无机化合物可根据其组成和性质进行分类。
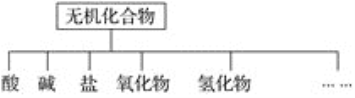
(1)上图所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表中。
___________、______________、_______________
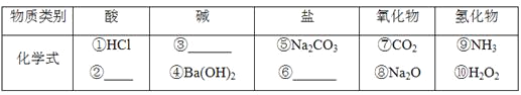
(3)写出⑦转化为⑤的化学方程式:__________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是_______________________。
【答案】树状分类法 H2SO4(或HNO3等均可) NaOH(或KOH) Na2SO4(或K2CO3或Na2SO3或NaNO3等均可) 2NaOH+CO2=Na2CO3+H2O 稀盐酸 大理石(或石灰石) 将气体通入澄清石灰水中,若变浑浊,即可证明是CO2
【解析】
(1)根据树状分类法和交叉分类法的定义作答,树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有根、杆、枝、叶;
(2)题目中元素形成的酸还有H2SO4、HNO3等;形成的碱还有NaOH(或KOH);形成的盐还可以是Na2SO4或K2CO3或Na2SO3或NaNO3等;
(3)二氧化碳和氢氧化钠反应生成碳酸钠和水;
(4)实验室制取二氧化碳常用大理石(或者石灰石)与稀盐酸反应;二氧化碳使澄清石灰水变浑浊,故常用澄清的石灰水检验二氧化碳,即将气体通入澄清石灰水,石灰水变浑浊则说明该气体是二氧化碳。
(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有根、杆、枝、叶,图示方法就是树状图,
故答案为树状分类法;
(2)题目中元素形成的酸还有H2SO4、HNO3等;形成的碱还有NaOH(或KOH);形成的盐还可以是Na2SO4或K2CO3或Na2SO3或NaNO3等,
故答案为:H2SO4(或HNO3等均可);NaOH(或KOH);Na2SO4(或K2CO3或Na2SO3或NaNO3等均可);
(3)二氧化碳和氢氧化钠反应生成碳酸钠和水,其化学方程式为:2NaOH+CO2=Na2CO3+H2O,
故答案为:2NaOH+CO2=Na2CO3+H2O;
(4)实验室制取二氧化碳常用大理石或者石灰石与稀盐酸反应;二氧化碳使澄清石灰水变浑浊,故常用澄清的石灰水检验二氧化碳,即将气体通入澄清石灰水,石灰水变浑浊则说明该气体是二氧化碳,
故答案为:大理石(或石灰石);将气体通入澄清石灰水中,若变浑浊,即可证明是CO2。


科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数。
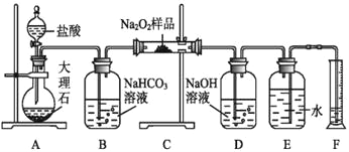
①A中发生反应离子方程式为 ____________________________________ 。
②将仪器连接好以后,必须进行的第一步操作是___________________________。
③B装置出来的气体是否需要干燥____(填“是”或“否”)。
④D中NaOH溶液的作用_______________________
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为 _______________
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入氦气、氧气、氮气,当它们的温度和密度都相同时,这三种气体的压强(P)从大到小的顺序是( )
A.氦气>氧气>氮气
B.氧气>氮气>氦气
C.氧气>氦气>氮气
D.氦气>氮气>氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液,当后一种溶液逐滴加入到一定量的前一种溶液中并稍过量,其溶液的导电性(I表示导电能力)与后一种溶液的质量(m)的函数关系符合下图的是
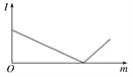
A. 澄清石灰水、碳酸钠溶液
B. 硝酸银溶液、氯化钠溶液
C. 盐酸、氢氧化钠溶液
D. 稀硫酸、氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 27g Al与NaOH完全反应,转移的电子数为0.1NA
B. 1L 1mol/L CaC12溶液中含有的Cl-离子数目为NA
C. 标准状况下,22.4L水含有1mol水分子
D. 2mol钠与过量稀盐酸反应生成NA个氢气分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的说法中,正确的是
A. 热稳定性:Na2CO3<NaHCO3
B. 相同温度下在水中的溶解度:Na2CO3<NaHCO3
C. 取1 mol·L-1的两种溶液,分别滴加澄清石灰水,有沉淀生成的是Na2CO3溶液
D. 取等质量的两种固体分别与等浓度等体积的盐酸反应,生成气泡较快的是NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲测定铁铝合金的组成,将铁铝合金溶解后,取试样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚易挥发,易燃烧。
回答下列问题:
(1)常温下,将铁铝合金溶解的试剂是_________(填字母)。
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.浓硝酸
(2)已知氢氧化铁实际上是三氧化二铁的水合物,则通过称量氢氧化铁固体质量的方法来确定c(Fe3+)时,该方案理论上的主要缺点是________________________。
(3)操作X是___________________________,操作X后检验溶液中是否有Fe3+残留的方法是_______________________________。
(4)蒸馏装置如图所示,装置中存在的错误是___________________________。

(5)将含Fe3+的溶液定容至100mL需要的仪器是___________________________。
(6)已知滴定反应为Ce4++Fe2+=Ce3++Fe3+,当滴定达到终点时,消耗0.1000 mol·L-1Ce(SO4)2溶液15.00 mL,则开始试样中c(Fe3+)=_____________。若改用稀硫酸酸化的K2Cr2O7溶液滴定含Fe2+的待测液,则该过程的离子反应方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下列可用于分离和提纯物质的方法是
(1)除去CaO中混有的CaCO3颗粒____
(2)分离CCl4和水的混合物_____
(3)分离溴水中的溴和水______
(4)除去澄清石灰水中悬浮的CaCO3颗粒______
II、掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:①_____________④______________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器____________;进行I分离操作时进水口为______(填f或g)。
(3)现需配制500mL 0.2 mol/L NaOH溶液,其中装置II是该同学转移溶液的示意图,该同学操作的错误是 _______________;_____________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com