
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数。
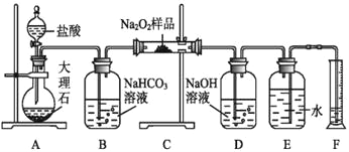
①A中发生反应离子方程式为 ____________________________________ 。
②将仪器连接好以后,必须进行的第一步操作是___________________________。
③B装置出来的气体是否需要干燥____(填“是”或“否”)。
④D中NaOH溶液的作用_______________________
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为 _______________
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________(填“偏大”“偏小”或“不影响”)。
【答案】CaCl2或BaCl2溶液 CaCO3+2H+===Ca2++H2O+CO2↑ 检查装置的气密性 否 吸收未反应的CO2 39V/56a% 偏小
【解析】
(1)过氧化钠在空气中变质会最后生成碳酸钠固体,依据碳酸根离子检验是否变质;
(2)装置图中A为生成二氧化碳的装置,B为洗气装置,C为二氧化碳与过氧化钠反应的装置,D为吸收多余的二氧化碳的装置,E和F是测量生成氧气的体积的装置,据此分析解答。
(1)过氧化钠在空气中变质会最后生成碳酸钠固体,探究一包过氧化钠样品是否已经变质,可以利用碳酸根离子和钡离子或钙离子结合生成碳酸钡或碳酸钙白色沉淀证明Na2O2已经变质,取少量样品,溶解,加入CaCl2或BaCl2溶液,充分振荡后有白色沉淀,证明Na2O2已经变质;
(2)①A中发生反应是碳酸钙和盐酸反应生成二氧化碳、水和氯化钙,反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑;
②实验探究测定方法是测定二氧化碳和过氧化钠反应生成的氧气,装置中必须是气密性完好,将仪器连接好以后,必须进行的第一步操作是检查装置的气密性;
③B装置出来的气体不需要干燥,因为二氧化碳、水蒸气和过氧化钠反应均生成氧气,反应的化学方程式为:2CO2+2Na2O2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,过氧化钠反应生成氧气的物质的量定量关系相同对测定过氧化钠质量分数无影响,所以不需要干燥除去水蒸气;
④装置C中是二氧化碳、水蒸气和过氧化钠反应生成氧气的反应,反应中二氧化碳是过量的,则D为吸收多余的二氧化碳的装置,防止多余的二氧化碳进入量气装置,导致测得的氧气的体积偏大;
⑤测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,物质的量为![]() ,则样品中过氧化钠的物质的量是
,则样品中过氧化钠的物质的量是![]() ,质量是
,质量是![]() ,所以质量分数为
,所以质量分数为![]() ;
;
⑥实验完成后E到F之间导管内残留水的体积会使测定氧气体积减小,导致测定过氧化钠质量分数测量结果偏小。


科目:高中化学 来源: 题型:
【题目】元素性质呈现周期性变化的根本原因是
A.原子半径呈周期性变化B.元素化合价呈周期性变化
C.元素的相对原子质量D.元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu = 2Fe2++ Cu2+。下列有关说法错误的是( )
A.Cu是还原剂,被腐蚀
B.Fe3+是氧化剂
C.该反应是置换反应
D.该反应属于离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“稀土”是我国宝贵的战略资源。已知稀土元素钐(Sm)的原子序数是62,Sm的某种同位素中子数是82,其质量数是( )
A.144B.82C.62D.20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是
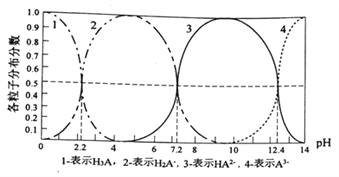
A. NaH2A水溶液呈碱性
B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+![]() c(HA2-)+
c(HA2-)+![]() c(A3-)
c(A3-)
C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,![]()
D. 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
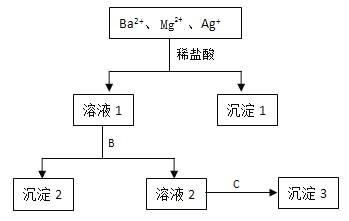
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图是研究甲烷与氯气反应的实验装置图。
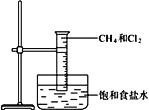
(1)CCl4的电子式:________________。
(2)二氯甲烷_____________同分异构体(填“有”或“没有”)。
(3)请完成一氯甲烷与氯气发生反应的化学方程式:CH3Cl+Cl2![]() ________+HCl,该反应属于反应_________(填有机反应类型)。
________+HCl,该反应属于反应_________(填有机反应类型)。
Ⅱ.(4)写出下列有机物的结构简式:
①2,2﹣二甲基戊烷:_____________
②3﹣甲基﹣1﹣丁烯:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。
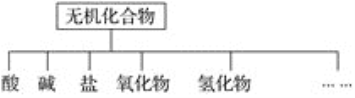
(1)上图所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表中。
___________、______________、_______________
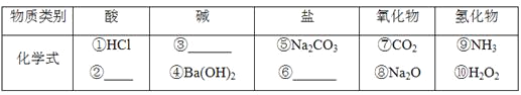
(3)写出⑦转化为⑤的化学方程式:__________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可分为一次能源和二次能源,自然界中以现成形式提供的能源称为一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。据此判断,下列叙述正确的是
A. 天然气是二次能源 B. 石油是二次能源
C. 电能是一次能源 D. 水流是一次能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com