
【题目】燃料电池的优点有能量转化效率高、无污染等。下图是乙醇燃料电池(BFC)的示意图,a、b为置于多孔陶瓷管中的纳米碳纤维电极。下列有关该电池的说法不正确的是
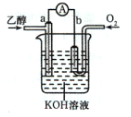
A.电子由a极经外电路导线流向b极
B.b极的电极反应式为:O2+4H++4e-=2H2O
C.该电池的总反应式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O
D.用该电池电镀铜时,若待镀金属增重12.8 g,至少消耗标准状况下的氧气2.24 L
【答案】B
【解析】
根据装置图可知通入燃料乙醇的a电极为负极,通入O2的b电极为正极。
A.根据图示可知,通入燃料乙醇的电极为负极,失去电子发生氧化反应,电子由负极a电极经外电路导线流向b极,A正确;
B.在正极b上,溶液为碱性,不可能含有大量H+,O2获得电子,发生还原反应,产生OH-,电极反应式为:O2+4e-+2H2O=4OH-,B错误;
C.电池负极发生反应:C2H5OH-12e-+14OH-=2CO32-+7H2O,正极的电极反应式为:O2+4e-+2H2O=4OH-,所以该电池的总反应式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O,C正确;
D.用该电池电镀铜时,若待镀金属增重12.8 g,n(Cu)=12.8g÷64g/mol=0.2mol,由于Cu是+2价的金属,所以电子转移的物质的量是n(e-)=0.2mol×2=0.4mol,由于1molO2反应转移4mol电子,所以转移0.4mol电子,消耗氧气0.1mol,则消耗的O2在标准状况下体积V(O2)=0.1mol×22.4L/mol=2.24 L,反应物不可能完全发生反应,因此消耗的氧气的体积在标准情况下大于2.24L,D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】如图是从NaCl和CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
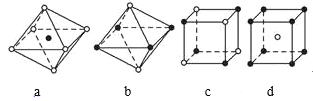
A.只有cB.b和cC.a和cD.a和d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
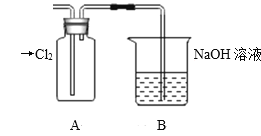
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池与电解池在生活和生产中有着广泛应用。下列有关判断中正确的是
A.装置甲研究的是电解CuCl2溶液,阳极发生的反应:2Cl-+2e-===Cl2↑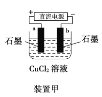
B.装置乙研究的是金属的吸氧腐蚀,Fe上的反应为Fe-3e-===Fe3+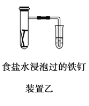
C.装置丙研究的是电解饱和食盐水,B电极发生的反应:2H2O+2e-===H2↑+2OH-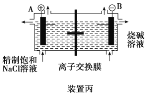
D.向装置丁烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成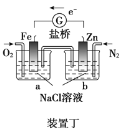
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)。下列有关该反应的推理错误的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理错误的是
A.该反应达到平衡时:c(Cu2+)=c(Mn2+)
B.相同温度下,CuS的溶解度比MnS的溶解度小
C.向含有等物质的量的CuSO4和MnSO4混合溶液中逐滴加入Na2S溶液,最先出现CuS沉淀
D.往平衡体系中加入少量CuSO4(s)后,c(Mn2+)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于盐类水解反应的是
A. Na2CO3溶液:CO32- + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. NaHCO3溶液:HCO3- + H2O ![]() CO32- + H3O+
CO32- + H3O+
C. NaHS溶液:HS- + H2O ![]() H2S + OH-
H2S + OH-
D. KF溶液:F- + H2O = HF + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期主族元素,a的第三电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d属于同周期元素,且d的原子半径小于c的原子半径。下列叙述错误的是( )
A.四种元素中,元素d的非金属性最强
B.元素a、b、c均存在两种或两种以上的氧化物
C.只有元素a与题述其他元素生成的化合物都是离子化合物
D.元素c、d分别与氢元素形成的最简单氢化物中的化学键均为非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产、生活中有极其广泛的用途。
(1)化学式Mg17Al12的合金是一种新型的纳米储氢合金,其储氢原来理为Mg17Al12+17H2=17MgH2+12Al,得到的混合物X(17MgH2+12Al)在一定条件下能释放出H2。
①MgH2中氢元素的化合价为____。
②将X与足量的NaOH溶液混合可得到H2,则766gX充分反应后可得到___molH2。
(2)将铝片放在汞盐溶液中,其表面会形成铝汞合金(铝表面的氧化膜被破坏了),从溶液中取出铝并放置在空气中,铝片表面会迅速长出胡须状的“白毛”(主要成分为Al2O3),同时放出大量的热.导致迅速长出“白毛”的原因可能有:一是铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应;二是___。确定前一种可能原因是否存在的简单方法是___。
(3)无水AlCl3可用作有机合成的催化剂,工业上可用Al2O3、Cl2、焦炭混合反应制备无水AlCl3,该反应的另一种产物是可燃性气体,写出该反应的化学方程式:___。
(4)聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,它是应用广泛的高效净水剂。
①PAFC在强酸性和强碱性溶液中均会失去净水作用,原因是____。
②为检测PAFC中Al和Fe的含量,设计如图所示的流程:

试剂A是____,步骤②中发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20号主族元素,原子序数依次增大,
都是元素周期表中前20号主族元素,原子序数依次增大,![]() 是地壳中含量最高的元素,
是地壳中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氢化物及其最高价氧化物对应的水化物均为强酸,且
的氢化物及其最高价氧化物对应的水化物均为强酸,且![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)![]() 四种元素中,原子半径最大的是______(填元素符号);
四种元素中,原子半径最大的是______(填元素符号);![]() 和
和![]() 的简单氢化物中,沸点较低的是______(填化学式)。
的简单氢化物中,沸点较低的是______(填化学式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多种盐,其中一种盐中
可以形成多种盐,其中一种盐中![]() 、
、![]() 、
、![]() 三种元素的原子个数比为
三种元素的原子个数比为![]() ,该盐的化学名称为______。它的水溶液与
,该盐的化学名称为______。它的水溶液与![]() 的氢化物的水溶液反应可生成
的氢化物的水溶液反应可生成![]() 的单质,该反应的离子方程式______________________________,反应生成
的单质,该反应的离子方程式______________________________,反应生成![]() 的单质时,转移电子______
的单质时,转移电子______![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com