
【题目】已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2有关其说法正确的是( )
Cd(OH)2+2Ni(OH)2有关其说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.放电时负极附近溶液的碱性不变
C.放电时电解质溶液中的OH﹣向正极移动
D.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣=NiOOH+H2O
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是
A.物质的量比为1∶1B.分子数比为16∶11C.体积比为1∶1D.体积比为11∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室研究Fe与H2SO4的反应

【实验分析】
(1)实验I中,铁与稀硫酸反应的离子方程式为________________。
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,这一现象被称为___________________。
(3)实验Ⅲ,己知: 浓H2SO4 的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体B中品红褪色,D处始终未检测到可燃性气体。A 中产生的气体是__,装置C 的作用是________________。
(4)实验Ⅲ结束后,经检验A 中既有Fe3+又有不少的Fe2+。
①若要检验Fe3+和Fe2+,下列试剂组可行的是______ (填字母)。
A.KSCN、Fe粉 B.KSCN、酸性KMnO4溶液 C.KSCN、氯水
[实验反思]
(5)①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于_____,稀硫酸的氧化性源于_______________。
②影响反应产物多样性的因素有_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
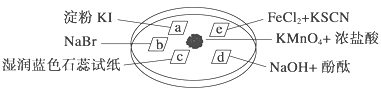
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题 
(1)肼燃料电池原理如图所示,N2H4通入的一极应为电池的极(填“正”或“负”).
(2)火箭常用N2O4作氧化剂,肼作燃料,已知: N2(g)+2O2(g)═2NO2(g)△H=﹣67.7kJmol﹣1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534.0kJmol﹣1
2NO2(g)N2O4(g)△H=﹣52.7kJmol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式 .
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可用尿素[CO(NH2)2]和次氯酸钠﹣氢氧化钠溶液反应获得,请写出尿素法反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等.
(1)下列△H表示物质标准燃烧热的是 ;表示中和反应反应热的是 .(填“△H1”、“△H2”、“△H3”等)
A.2H2(g)+O2(g)═2H2O(l)△H1B.C(s)+![]() O2(g)═CO(g)△H2=﹣Q1kJmol﹣1
O2(g)═CO(g)△H2=﹣Q1kJmol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3D.C(s)+O2(g)═CO2(g)△H4=﹣Q2kJmol﹣1
E.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H5
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应的热化学方程式: .
(3)根据题(1)中B、D判断1molCO(g)完全燃烧的△H= .
(4)反应E的△H6可以用如图所示的装置进行测量.实验中直接测定的数据是 ;从实验装置上看,图中尚缺少的一种玻璃用品是 ;大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值 (填“偏大”“偏小”或“无影响”).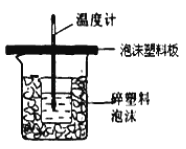
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com