
����Ŀ����14�֣�Ϊ�ⶨij�л�������A�Ľṹ����������ʵ�飺
��һ������ʽ��ȷ����
��1�����л���A�����������г��ȼ�գ�ʵ���ã�����5.4g H2O��8.8g CO2����������6.72L����״���£�����������и�Ԫ�ص�ԭ�Ӹ������� ��
��2���������Dzⶨ���л����������Է����������õ���ͼ����ʾ����ͼ��������Է�������Ϊ �������ʵķ���ʽ�� ��
��3�����ݼۼ����ۣ�Ԥ��A�Ŀ��ܽṹ��д���ṹ��ʽ �� ��
�������ṹʽ��ȷ����
��4���˴Ź��������ܶ��л�������в�ͬ��ѧ��������ԭ�Ӹ�����ͬ�ķ�ֵ���źţ������ݷ�ֵ���źţ�����ȷ����������ԭ�ӵ��������Ŀ�����磺���ȼ��ѣ�ClCH2OCH3����������ԭ����ͼ�������ⶨ���л���A�ĺ˴Ź�������ʾ��ͼ��ͼ������A�Ľṹ��ʽΪ ��
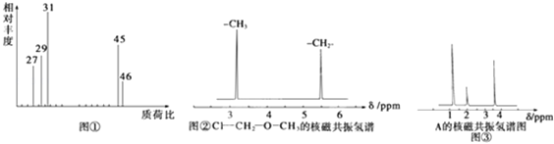
����������ʵ�飺
��5��A��һ����������ˮ������B��B�ɺϳɰ�װ����C����д��Bת��ΪC�Ļ�ѧ����ʽ�� ��
��6�����������е��˶�Ա����Ť��ʱ����ҽ�漴�������飨�е�Ϊ12.27���������˲�λ���оֲ��䶳����������Bѡ����ʵķ����Ʊ������飬Ҫ��ԭ��������Ϊ100%����д���Ʊ���Ӧ����ʽ�� ��
���𰸡���1��n��C����n��H����n��O��=2��6��1����2��46��C2H6O����3��CH3CH2OH��CH3OCH3��
��4��CH3CH2OH��
��5��![]() ��
��
��6�� CH2=CH2+HCl![]() CH3CH2Cl��
CH3CH2Cl��
��������
��1��n(CO2)=![]() =0.2mol��n(H2O)=
=0.2mol��n(H2O)=![]() =0.3mol��n(O2)=
=0.3mol��n(O2)=![]() =0.3mol����������غ㶨���ƶϣ�
=0.3mol����������غ㶨���ƶϣ�
��2�������Dzⶨ�л����������Է�������Ϊ46��������ʽ�жϷ���ʽΪC2H6O��
��3��A����Ϊ�Ҵ�������ѣ�
��4���л���A�����������ֲ�ͬ��ѧ��������ԭ�ӣ�ӦΪ�Ҵ���������ֻ��һ�ֲ�ͬ��ѧ��������ԭ�ӣ�
��5��A��һ����������ˮ������B��BΪCH2=CH2��B�ɺϳɰ�װ����C��CΪ����ϩ��
��6��ԭ��������Ϊ100%�����üӳɷ����Ʊ���
��1�������������֪�����л����У�n(C)=n(CO2)=![]() =0.2mol��n(H)=2n(H2O)=2��
=0.2mol��n(H)=2n(H2O)=2��![]() =0.6mol����Ӧ�������������ʵ���n(O2)=
=0.6mol����Ӧ�������������ʵ���n(O2)=![]() =0.3mol������л�������ԭ�ӵ����ʵ���n(O)=2n(CO2)+n(H2O)-2n(O2)=2��0.2mol+0.3mol-2��0.3mol=0.1mol����N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1��
=0.3mol������л�������ԭ�ӵ����ʵ���n(O)=2n(CO2)+n(H2O)-2n(O2)=2��0.2mol+0.3mol-2��0.3mol=0.1mol����N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1��
�ʴ�Ϊ��N(C):N(H):N(O)=2:6:1��
��2������Է�������Ϊ46����֪A�ķ���ʽΪC2H6O��
�ʴ�Ϊ��46��C2H6O��
��3��A����Ϊ�Ҵ�������ѣ��ṹ��ʽΪCH3CH2OH��CH3-O-CH3��
�ʴ�Ϊ��CH3CH2OH��CH3-O-CH3��
��4����ͼ��֪���л���A��������ԭ�ӣ�������ԭ�ӵĸ�������Ϊ3��1��2������A�Ľṹ��ʽΪCH3CH2OH��
�ʴ�Ϊ��CH3CH2OH��
��5��A��һ����������ˮ������B��BΪCH2=CH2��B�ɺϳɰ�װ����C��CΪ����ϩ��Bת��ΪC�Ļ�ѧ��Ӧ����ʽΪnCH2=CH2![]()
![]() ��
��
�ʴ�Ϊ��nCH2=CH2![]()
![]() ��
��
��6��ԭ��������Ϊ100%�����üӳɷ����Ʊ�����Ӧ�ķ���ʽΪCH2=CH2 +HCl ![]() CH3CH2Cl��
CH3CH2Cl��
�ʴ�Ϊ��CH2=CH2 +HCl ![]() CH3CH2Cl��
CH3CH2Cl��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ɫ�Լ���˫��ˮ����Ϊ��ҵ��Һ����������Ҫ�����ɿ�ҵ��Һ�е��軯����KCN����ѧ����ʽΪ��KCN+H2O2+KOH��K2CO3+NH3����
��1���ڻ�ѧ����ʽ�ϱ������ת�Ʒ������Ŀ___��
��2����Ӧ�б�������Ԫ��Ϊ___��KOH�ĵ���ʽΪ___��
��3��NH3������N��H��Ϊ__����Ի�Ǽ��ԣ����ۼ���
��4��H2O2����___����ۻ����ӣ������
��5��д����Һ�з����÷�Ӧʱ�����ɵĻ�ѧ������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�������ֵ������������ȷ����
A.1mol ICl��H2O��ȫ��Ӧ�����Ȼ���ʹε��ᣬת�Ƶĵ�����ΪNA
B.���³�ѹ�£�56 g��ϩ (C4H8)�к��еĹ��۵�������Ϊ8 NA
C.��⾫��ͭʱ��������������64g���պϻ�·ת�Ƶĵ�����һ��Ϊ2NA
D.������Ϊ3.2g��S2��S4��S6������Sԭ������ȣ���Ϊ0.1 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���Ϊ2L���ܱ�������A��B�������巴Ӧ����C��D��������Ŀ��淴Ӧ3A+B![]() xC+2D����ϵ�У���һ��ʼ����ϵ�г���3molA��3molB���壬2minĩ��Ӧ�ﵽƽ��״̬������1molD�������C��Ũ��Ϊ0.5mol/L���ɴ��ƶϣ�
xC+2D����ϵ�У���һ��ʼ����ϵ�г���3molA��3molB���壬2minĩ��Ӧ�ﵽƽ��״̬������1molD�������C��Ũ��Ϊ0.5mol/L���ɴ��ƶϣ�
��1��xֵ����___��
��2��ƽ��ʱB��Ũ��Ϊ___��
��3������D�ķ�Ӧ����___��
��4���Լ��㷴Ӧǰ��ƽ��ʱ����ѹǿ֮��Ϊ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һ���ۺϴ���SO2�����Ĺ������̣���ÿ������ȫ��Ӧ������˵����ȷ���ǣ� ��

A.��ҺB�з����ķ�ӦΪ2SO2+O2=2SO3
B.�������Ը��������Һ������ҺC���Ƿ���Fe3+
C.���������̿���֪�����ԣ�O2>SO42-
D.������ҺB���Ƿ�Fe2+�ķ���������ҺB�м������軯����Һ��������Ȼ�����˫��ˮ��Һ���۲��Ƿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ����������������ȷ���ǣ� ��
A.��������ΪNA��NO2��CO2��������к��е���ԭ����Ϊ2NA
B.28g��ϩ�ͱ�ϩ��C3H6���Ļ�������к��е�̼ԭ����Ϊ2NA
C.���³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
D.���³�ѹ�£�22.4L����������H2��ַ�Ӧ ������HCl�ķ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶�ʱ����һ��10L�ĺ���������X��Y��Z��Ϊ���壬�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ��������գ�
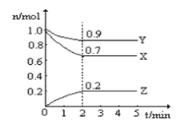
�Ÿ÷�Ӧ�Ļ�ѧ����ʽΪ___________��
�Ʒ�Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����Ϊ___________��
��ƽ��ʱ�����ڻ�������ܶȱ���ʼʱ_________�����������������С��������������ͬ������������ƽ����Է�����������ʼʱ___________��
�Ƚ�amolX��bmolY�Ļ�����巢��������Ӧ����Ӧ��ijʱ�̸����ʵ���ǡ�����㣺n(X)=n(Y)=2n(Z)����ԭ���������a��b=__________��
����֪�����������Һ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪNa2S2O3+H2SO4= Na2SO4+ SO2��+S��+H2O��ijѧϰС��̽��һ��������Ӱ�컯ѧ��Ӧ���ʵ����أ����±���ʾ��
�ɶԱ�ʵ��I��III���Եó��Ľ�����______________��ʵ��I��II̽������___________��Ũ��Խ�÷�Ӧ����Խ�죬��ʵ��III��IVҲ��ó�ͬ�����ۣ�X=___________��Y= _________��
ʵ����� | �¶� | Na2S2O3��Һ | ϡH2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
I | 25 | 5 | 0��1 | 10 | 0��1 | 5 |
II | 25 | 5 | 0��2 | 5 | 0��2 | 10 |
III | 35 | 5 | 0��1 | 10 | 0��1 | 5 |
IV | 35 | 5 | 0��2 | X | 0��2 | Y |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ᾭ�õķ�չ�������ѽ���ǧ�����������dz��д��������ͬʱ����β����Ⱦ����Ҳ����ͻ�ԣ�����β���к�![]() �������������ȡ��û���̿��ԭ��������������һ��ʵ�õĵ�������ת��������
�������������ȡ��û���̿��ԭ��������������һ��ʵ�õĵ�������ת��������![]() ����ʵ�ֵ���������ת�������л�������������β���Ĵ����ŷ��ص���( )
����ʵ�ֵ���������ת�������л�������������β���Ĵ����ŷ��ص���( )
A.����B.����ЧӦC.PM 2.5����D.��ɫ��Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С��Ϊ����֤Ԫ�طǽ����Եݱ���ɣ��������ͼ��ʾ������ʵ�鷽������ʵ��̽����
����һ��
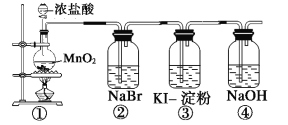
��1�����ݷ���һװ�ûش��������⣺
д��װ�âٷ����Ļ�ѧ��Ӧ����ʽ��___��������Ӧ����е���Һ���뱽�У����ú��ֵ���������ͼ�Ǻϵ���___��������ţ�װ�â��е�������___��

��2�����ݷ�����װ�ûش��������⣺
��������

��������֤Ԫ�طǽ����Եݱ�����������ǣ�___��Bװ�õ�������___��X�Լ���___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com