
【题目】Ⅰ.某温度时,在一个10L的恒容容器中X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
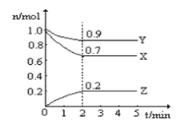
⑴该反应的化学方程式为___________;
⑵反应开始至2min,以气体Z表示的平均反应速率为___________;
⑶平衡时容器内混合气体密度比起始时_________(填“变大”,“变小”或“不变”下同),混合气体的平均相对分子质量比起始时___________;
⑷将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=__________。
Ⅱ.已知硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4= Na2SO4+ SO2↑+S↓+H2O,某学习小组探究一定条件下影响化学反应速率的因素,如下表所示:
⑸对比实验I、III可以得出的结论是______________,实验I、II探究的是___________的浓度越大,该反应速率越快,若实验III、IV也想得出同样结论,X=___________,Y= _________。
实验序号 | 温度 | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
I | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
II | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
III | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
IV | 35 | 5 | 0.2 | X | 0.2 | Y |
【答案】3X+Y2Z 0.01mol/(Lmin) 不变 变大 7:5 当其他条件不变时,温度越高,化学反应速率越快 Na2S2O3溶液 5 10
【解析】
Ⅰ.(1)化学方程式中,反应的物质系数之比等于各个物质的量的变化量之比;
(2)根据化反应速率v=![]() 来计算化学反应速率;
来计算化学反应速率;
(3)混合气体的平均相对分子质量M=![]() ,混合气体密度ρ=
,混合气体密度ρ=![]() 来判断;
来判断;
(4)根据化学反应中的三段式进行计算;
Ⅱ.表中给出的数据为浓度和温度的影响,一般来说,浓度越大,温度越高,反应速率越大,以此解答该题。
Ⅰ.(1)根据图示的内容知道,X和Y是反应物,X、Y、Z的变化量之比是0.3:0.1:0.2=3:1:2,反应的化学方程式为:3X+Y![]() 2Z;
2Z;
(2)反应开始至2min,以气体Z表示的平均反应速率v= =0.01 mol/(L·min);
=0.01 mol/(L·min);
(3)混合气体密度ρ=![]() ,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,混合气体的平均相对分子质量M=
,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,混合气体的平均相对分子质量M=![]() ,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,故答案为:相等;大;
,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,故答案为:相等;大;
(4) 3X+Y![]() 2Z(设Y的变化量是x)
2Z(设Y的变化量是x)
初始量:a b 0
变化量:3x x 2x
平衡量:a-3x b-x 2x
当n (X)=n (Y)=2n (Z)时,a-3x=b-x=4x,则a=7x,b=5x,所以原混合气体中a:b=7:5;
Ⅱ.⑸对比实验I、III只有温度不同,可以得出的结论是当其他条件不变时,温度越高,化学反应速率越快,实验I、II只有Na2S2O3溶液的浓度不同,其他条件相同,故探究的是Na2S2O3溶液的浓度越大,该反应速率越快,若实验III、IV也想得出同样结论,则应除温度外保持与II的数据相同,则X=5,Y=10。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HClO、H2CO3、H2SO4、HClO4的酸性依次增强
B. 苹果酸![]() 含有1个手性碳原子
含有1个手性碳原子
C. HF、NH3、CH3OH均易溶于水的原因之一是与H2O分子均形成氢键
D. 以极性键结合的分子一定不是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气燃烧,该反应是___反应(填“吸热”或“放热”),这是由于反应物的总能量___(填“大于”“小于”或“等于”)生成物的总能量;从化学反应的本质来看,是由于断裂反应物中的化学键吸收的总能量___(填“大于”“小于”或“等于”)形成产物的化学键放出的总能量。
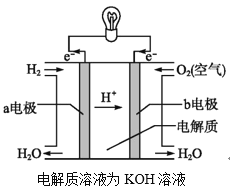
(2)通过氢气的燃烧反应,可以把氢气中储存的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中储存的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池。
该电池的正极是___(填“a电极”或“b电极”),电极反应式为___,该电极上的物质发生反应的反应类型是___(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)为测定某有机化合物A的结构,进行如下实验:
(一)分子式的确定:
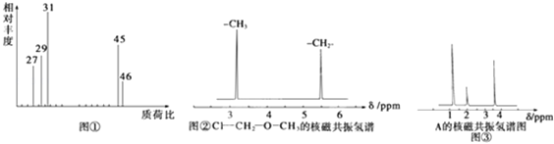
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质中各元素的原子个数比是 .
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为 ,该物质的分子式是 .
(3)根据价键理论,预测A的可能结构并写出结构简式 、 .
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图②.经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为 .
(三)性质实验:
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学方程式: .
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图:

(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是______。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:
A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A._____,B._____。(填“能”或“不能”)
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
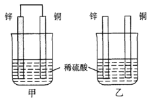
①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲________乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的负极电极反应式_________________________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入__极(填a或b),电子从____(填a或b)极流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铝的几种重要化合物之间的转化关系,下列表述不正确的是( )
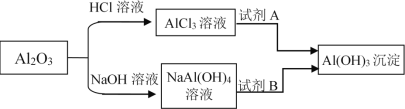
A.若加入的A是NaHCO3溶液,则生成沉淀的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,溶液的pH增大
B.若加入的B是NaHCO3溶液,则生成沉淀的离子方程式为:Al(OH)4- + HCO3-=Al(OH)3↓+CO32-+H2O,溶液的pH减小
C.向AlCl3溶液中加入一定质量的Al(OH)3固体,一段时间后过滤,将所得固体洗涤干燥,称量,固体质量将增加
D.若加入的A是氨水、NaOH溶液或CH3COONa溶液等;或加入的B是NH4HCO3溶液、NH4Cl溶液或通入SO2、CO2气体等,均可析出Al(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物6g完全燃烧,生成![]() 和
和![]() (标准状况下),0.5mol此有机物的质量为30g。
(标准状况下),0.5mol此有机物的质量为30g。
(1)通过计算确定该有机物的分子式:_________(写出必要的计算过程)
(2)该有机物有有多种同分异构体。其一能使紫色石蕊试液变红,则该有机物的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应N2(g)+3H2(g) ![]() 2NH3(g)+92.2kJ。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
2NH3(g)+92.2kJ。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
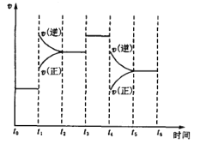
A.t0~t1B.t2~t3C.t3~t4D.t5~t6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com