
【题目】有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.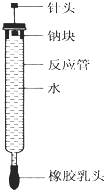
(1)钠与水反应的离子方程式为 .
(2)实验中“钠块熔化为闪亮的小球”说明;向烧杯中的溶液中滴加 , 溶液变红,说明钠与水反应生成碱性物质.
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为g.(设当时实验条件下气体摩尔体积为V mL/mol,写出简要步骤)
【答案】
(1)2Na+2H2O=2Na++2OH﹣+H2↑
(2)钠的熔点低,反应放热;酚酞溶液
(3)![]()
【解析】解:(1)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2Na++2OH﹣+H2↑;故答案为:2Na+2H2O=2Na++2OH﹣+H2↑;(2)钠块熔化为闪亮的小球,说明钠的熔点低,反应放热;钠与水反应生成氢氧化钠,溶液呈碱性,滴加酚酞溶液变红;故答案为:钠的熔点低,反应放热;酚酞溶液;(3)实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,即氢气的体积为a mL,其物质的量为 ![]() =
= ![]() mol,
mol,
由2Na+2H2O=2NaOH+H2↑
2 1
n(Na) ![]() mol
mol
n(Na)= ![]() mol×2=
mol×2= ![]() mol,质量为m(Na)=
mol,质量为m(Na)= ![]() mol×23g/mol=
mol×23g/mol= ![]() g;
g;
故答案为: ![]() ;
;
(1)钠与水反应生成氢氧化钠和氢气;(2)钠块熔化为闪亮的小球,说明钠的熔点低,反应放热;钠与水反应生成氢氧化钠,溶液呈碱性;(3)根据实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,即氢气的体积为a mL,利用化学方程式2Na+2H2O=2NaOH+H2↑;


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应:OH﹣+H+=H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D.二氧化碳与足量的氢氧化钠反应:CO2+2OH﹣=CO ![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)2NH3(g);△H=﹣92.4kJmol﹣1 . 请回答: 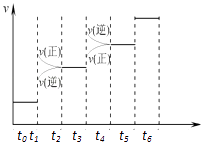
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是 . 其中表示平衡混合物中NH3的含量最高的一段时是 .
(2)温度为T℃时,将2mol H2和1mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则平衡时 H2的浓度 .
(3)当温度升高时,反应的化学平衡常数K值(增大、减小、无影响).
(4)已知单质硫的燃烧热为296kJmol﹣1 , 写出其燃烧的燃烧热方程式: .
(5)已知中和热为57.3kJmol﹣1 , 写出NaOH和H2SO4反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000molL﹣1的NaOH溶液分别滴定20.00mL浓度均为0.1000molL﹣1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( ) 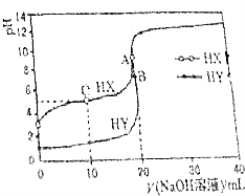
A.根据滴定曲线,可得Ka(CH3COOH)≈10﹣5
B.pH=7时,滴定醋酸溶液消耗的V(NaOH溶液)<20mL
C.C点溶液:c(HX)>c(X﹣)>c(Na+)>c(H+)>c(OH﹣)
D.当V(NaOH溶液)=20mL时,A点水电离出c(H+)大于B点水电离出的c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种可用于净水和膨化食品的盐,由A,B,C,D,E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D,E同主族.某同学为探究甲的组成而进行如下实验:
①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL.
回答下列问题:
(1)D在元素周期表中的位置为 .
(2)经测定晶体甲的摩尔质量为453gmol﹣1 , 其中阳离子和阴离子物质的量之比为1:1. 则晶体甲的化学式为 .
(3)图象中V(Oa):V(ab):V(bc)= 
(4)写出ab段发生反应的离子方程式: .
(5)配成的甲溶液物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳和硫的化合物的性质,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.
(1)有科学家提出可利用FeO吸收和利用CO2 , 相关热化学方程式如下: 6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=﹣76.0kJmol﹣1
①上述反应的还原产物为 , 每生成1mol Fe3O4 , 转移电子的物质的量为mol;
②已知:C(s)+2H2O(g)═CO2(g)+2H2(g)△H=+113.4kJmol﹣1 , 则反应:
3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)的△H= .
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)CH4(g)+2H2O(g).向一容积为2L的恒容密闭容器中充入一定量的CO2和H2 , 在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2molL﹣1 , H2 0.8molL﹣1 , CH4 0.8molL﹣1 , H2O 1.6molL﹣1 . 则300℃时上述反应的平衡常数K= . 200℃时该反应的平衡常数K=64.8,则该反应的△H(填“>”或“<”)0.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: 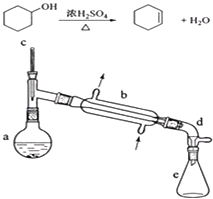
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是 .
(2)加入碎瓷片的作用是;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并;在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是 .
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列俗名与物质相匹配的一组是( )
A. 水玻璃——Na2SO4 B. 小苏打——NaHCO3 C. 石膏——CaSiO3 D. 胆矾——FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的操作方法中不正确的是
A. NO中有少量的NO2:用水洗涤后再干燥
B. 食盐中有少量的NH4Cl:直接加热
C. N2 中有少量的O2:通过灼热的铜网
D. Na2CO3中混有NH4HCO3:加过量的NaOH溶液加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com