
【题目】三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
铁含量的测定
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO4-被还原成Mn2+。重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液分别为19.98 mL和20.00 mL。请回答下列问题:
(1)滴定过程中,高锰酸钾溶液应盛装在__________滴定管中(填“酸式”或“碱式”)。
(2)用离子方程式表示步骤二中涉及到的相关化学反应:________________; Zn + 2Fe3+ = 2Fe2+ + Zn2+。
(3)步骤三中滴定终点的判定:____________________。
(4)在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量____________。在步骤三中,若滴定前仰视读数,滴定后俯视读数,则测得的铁含量__________。(选填“偏低”、“偏高”、“不变”)
(5)实验测得该晶体中铁的质量分数为__________。
【答案】酸式 2MnO4- + 5C2O42- + 16 H+ = 2Mn2+ + 10 CO2↑+ 8H2O 当最后一滴高锰酸钾加入后,溶液变为紫红(浅红色)色,且半分钟内不褪色 偏高 偏低 11.2%
【解析】
步骤二中涉及的反应为2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑+ 8H2O,Zn + 2Fe3+ = 2Fe2+ + Zn2+;故步骤二得到的溶液为硫酸钾、硫酸锌、硫酸锰及硫酸亚铁组成的混合溶液;步骤三涉及反应为MnO4- + 8H+ + 5Fe2+ = Mn2+ + 5Fe3++ 4H2O;结合实验和数据进行解答。
(1)高锰酸钾溶液有强氧化性,会腐蚀橡胶,则高锰酸钾溶液应盛装在酸式滴定管中,答案为酸式;
(2)根据分析可知,步骤二中涉及到的反应为2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑+ 8H2O,Zn + 2Fe3+ = 2Fe2+ + Zn2+;
(3)步骤三的反应为MnO4- + 8H+ + 5Fe2+ = Mn2+ + 5Fe3++ 4H2O,滴定终点为溶液中的亚铁离子消耗完全,滴加最后一滴酸性高锰酸钾溶液后,溶液由浅绿色变为紫红色,且半分钟内不褪色,答案为:当最后一滴高锰酸钾加入后,溶液变为紫红(浅红色)色,且半分钟内不褪色;
(4)若步骤二中的高锰酸钾量不够,则草酸有剩余,导致步骤三中消耗的高锰酸钾的量偏大,使测得的铁的含量偏高;步骤三中,滴定前仰视,读数偏大,滴定终点俯视,读数偏小,两次读数的差值为消耗高锰酸钾溶液的体积,体积偏小,则物质的量偏小,计算出的铁的含量偏低,答案为:偏高;偏低;
(5)步骤三中平均消耗高锰酸钾溶液的体积为=(20.02+19.98+20.00)mL÷3=20.00mL,n(MnO4-)=0.010mol/L×0.020L=0.0002mol,发生的反应为:MnO4- + 8H+ + 5Fe2+ = Mn2+ + 5Fe3++ 4H2O,n(MnO4-):n(Fe2+)=1:5,则铁元素的物质的量为n(MnO4-)×5=0.001mol,其质量为0.056g,质量分数为![]() ×100%=11.2%。
×100%=11.2%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为原子序数依次增大的四种短周期元素。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素,Z元素原子的最外层电子数是其电子层数的2倍。下列说法不正确的是
A.X与W形成化合物与稀盐酸反应不可能产生氧气
B.原子半径:X>Y>Z>W
C.简单氢化物的稳定性:W>Z>Y
D.Y与W形成化合物能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是______________________;
(2)该化合物的分子式为____________;
(3)该化合物1分子中存在1个苯环,且在核磁共振氢谱图中有4组吸收峰。试写出它可能的结构简式_______________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以CH3OH和空气为原料的燃料电池,电解质为KOH溶液。回答下列问题:
① OH-移向____________极。
② 负极反应式为__________________________________。
③ 电池中pH将逐渐______________(填增大、减少、不变)。
(2)用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电一段时间后, e极增重0.064g。则
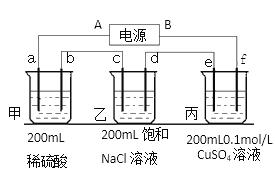
①电源B极是____________极。
②甲池a电极反应式为 ___________________________________________。
③乙池反应化学方程式________________________________________________。
④乙池共可收集到标准状况下气体体积为_____________mL,乙溶液的pH为___________。(常温,不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气多次肆虐我国中东部地区。其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
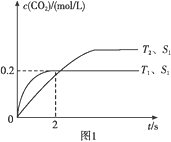
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和 时间(t)的变化曲线如图1所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和 时间(t)的变化曲线如图1所示。
据此判断:
①该反应的ΔH____0(填“>”或“<”)。
②在T1温度下,0~2 s内的平均反应速率υ(N2)=_____。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则CO转化率____(填“增大”“减小”或“不变”)。
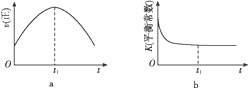
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____(填字母)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)ΔH=-867.0 kJ/mol
2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol
N2O4(g) ΔH=-56.9 kJ/mol
写出CH4催化还原N2O4(g)生成N2、CO2和H2O(g)的热化学方程式:_________________。
(3)工业上用CO2和H2反应合成二甲醚:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3 = -130.8 kJ/mol
CH3OCH3(g)+3H2O(g) △H3 = -130.8 kJ/mol
①一定条件下,上述反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是______________ (填代号)。
a.逆反应速率先增大后减小
b. H2的转化率增大
c.反应物的体积百分含量减小
d.容器中 ![]() 值变小
值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图2所示。KA、KB、Kc三者由大到小的关系是_____________________.

③上述合成二甲醚的过程中提高CO2的转化率可采取的措施有__________________、__________________(回答2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式分别为:
H2 (g) +![]() O2(g) = H2O (l) △H = -285.8 kJ /mol
O2(g) = H2O (l) △H = -285.8 kJ /mol
CO(g) +![]() O2(g) = CO2(g) △H = -283 kJ /mol
O2(g) = CO2(g) △H = -283 kJ /mol
C8H18 (l) +![]() O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
CH4 (g) + 2O2(g) = CO2(g) + 2H2O (l) △H = -890.3 kJ /mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2 (g)B.CO(g)C.C8H18 (l)D.CH4 (g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是( )

A. 反应①、②、③都属于氧化还原反应 B. X、Y、Z、W四种元素中,Y的原子半径最小
C. Na着火时,可用甲扑灭 D. 一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+5D反应中,表示该反应速率最快的是
3C+5D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s)B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s)D.υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A.在纯水中加入少量硫酸铵,可抑制水的电离.
B.升高温度,活化分子百分数一定增大,化学反应速率一定增大
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D.虽然固体氯化钠不能导电,但氯化钠是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com