
【题目】以某铬矿石(主要成分是Cr2O3,含FeO、SiO2等杂质)为原料生产Cr2O3的流程如下:
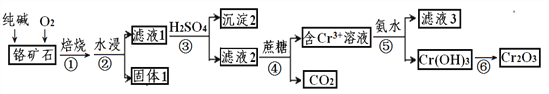
已知:Cr2O72-+H2O![]() 2CrO42-+2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
2CrO42-+2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
(1)步骤①中为了提高反应速率应该采取的措施有____、_____。(写2种)
(2)焙烧时Cr2O3被氧化成Na2CrO4,配平下面的化学方程式,并用单线桥表示电子转移的方向和数目:
Na2CO3+ Cr2O3+ O2![]() Na2CrO4 + CO2,______________
Na2CrO4 + CO2,______________
(3)流程中沉淀2为_________(填化学式)
(4)步骤④发生的反应中Cr2O72-和蔗糖(C12H22O11)的物质的量之比为_____。
(5)步骤⑤中为了使Cr3+完全沉淀[此时,c(Cr3+)≤10-5mol·L-1],pH至少调至____。
(6)滤液3中的主要溶质是两种盐,化学式为_________、________。
(7)另一种制取Cr(OH)3的工艺是将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3,则NaCrO2溶液与过量CO2反应的离子方程式为_____________________。。
【答案】 适当升温 粉碎铬矿石或搅拌等合理答案  H2SiO3 8:1 5.6 (NH4)2SO4 Na2SO4 CrO2- + CO2 +2H2O = Cr(OH)3↓+ HCO3-
H2SiO3 8:1 5.6 (NH4)2SO4 Na2SO4 CrO2- + CO2 +2H2O = Cr(OH)3↓+ HCO3-
【解析】(1)步骤①中为了提高反应速率应该采取的措施有适当升温 、粉碎铬矿石或搅拌等;正确答案: 适当升温 、粉碎铬矿石。
(2)Cr元素由+3价升高到+6价,氧元素由0价降低到-2价,根据元素得失电子数相等规律,找出最小公倍数,填系数最后根据原子守恒进行其他物质的配平。根据所填系数,可知该反应共转移电子12e-;单线桥注意是还原剂把电子给了氧化剂;正确答案:
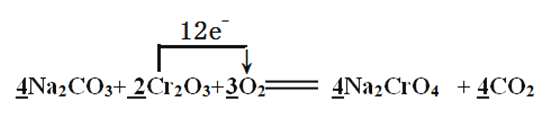
(3)二氧化硅与纯碱加热反应生成硅酸钠,加入稀硫酸后,产生了硅酸沉淀;正确答案:H2SiO3。
(4)根据流程分析看出:设Cr2O72-有xmol, C12H22O11有y mol,根据电子守恒:x×2×(6-3)=y×12×(4-0),解之得x:y=8:1;正确答案:8:1。
(5)根据Ksp[Cr(OH)3] = c(Cr3+)×c3(OH-)=10-5×c3(OH-)=6.4×10-31,c3(OH-)=6.4×10-26mol/L,c(OH-)=4×10-9mol/L, c(H+)=1/4×10-5mol/L, 已知lg2 = 0.3,pH=6-0.3=5.7;正确答案:5.6或5.7(近似值)
(6)整个流程中加入了碳酸钠、加入了硫酸,经过一系列反应后,溶液中剩下钠离子和硫酸根离子,加入氨水后,剩余铵根离子,因此滤液3中的主要溶质是两种盐,化学式为(NH4)2SO4 、 Na2SO4 ; 正确答案:NH4)2SO4 、Na2SO4。
(7)利用强酸制备弱酸的规律:NaCrO2溶液与过量CO2反应生成碳酸氢钠和Cr(OH)3,离子方程式:CrO2- + CO2 +2H2O = Cr(OH)3↓+ HCO3-;正确答案:CrO2- + CO2 +2H2O = Cr(OH)3↓+ HCO3-。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是( )
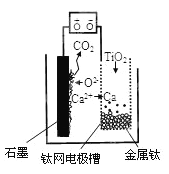
A. 将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的
B. 阳极的电极反应式为:C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 石墨为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN﹣;②Fe;③Fe2+;④Cu;⑤Zn;⑥OH﹣ .
A.①②③
B.②④⑤
C.①③⑥
D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。平衡常数如下表:下列说法正确的是( )
CH3OH(g)。平衡常数如下表:下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A. 该反应的△H> 0
B. 加压、增大H2浓度和加入催化剂都能提高CO的转化率
C. 工业上采用5 ×103 kPa和 250℃的条件,其原因是原料气的转化率高
D. t℃时,向 1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系:
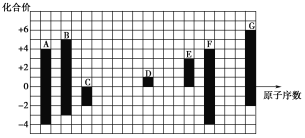
(1)元素A在周期表中的位置为________________________。
(2)用电子式表示D2G的形式过程:__________________________________,其所含化学键类型为__________。
(3)C2-、D+、G2-半径由大到小的顺序是________(填离子符号)。
(4)C、G的简单氢化物中,沸点较低的是________(填化学式),原因是________________。两种气态氢化物的稳定性C________G(填“>”或“<”)。
(5)C与D形成的具有强氧化性的化合物的电子式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com