
【题目】工业上从海水中提溴,实验室中从海带中提碘的过程中发生反应的离子方程式有:
![]()
![]()
![]()
回答下列问题:
(1)根据所给出的反应,判断![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 的氧化性强弱,可以明确得出的结论是____、___。
的氧化性强弱,可以明确得出的结论是____、___。
(2)将适量溴水加入氟化钠溶液中,__(填“能”或“不能”)观察到明显现象。
(3)将适量碘水加入氯化钠溶液中,__(填“能”或“不能”)观察到明显现象。
科目:高中化学 来源: 题型:
【题目】某温度时,在 2L 容器中发生 A 、B 两种物之间的转化反应 ,A、B 物质的量随时间变化的曲线如图所示,下列说法正确的是
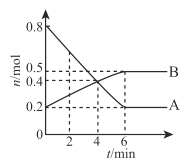
A.该反应的化学方程式是A![]() 2B
2B
B.2 min 时,正反应速率大于逆反应速率
C.4 min 时,A 、B 的物质的量相等且反应达到了平衡状态
D.反应开始至 6min,A 的平均反应速率为0. lmol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2等中学化学教材中出现过的物质,根据它们的组成及性质进行如下分类。
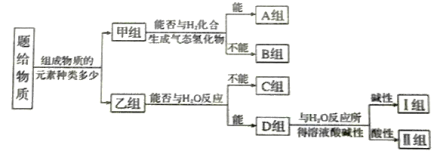
请回答下列问题:
(1)SO2属于_______________(填“酸性氧化物”、“碱性氧化物”、“两性氧化物”)。
(2)Na2O2最终位于________组;它的电子式为____________。
(3)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式:__________________________。
(4)II组的某种物质能与水发生氧化还原反应,该反应中被氧化与被还原的元素的质量比为_____________。
(5)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有0.8NA个电子转移则有_________g该物质参与反应。
(6)N2H4是一种高能燃料,有强还原性,可通过I组的某种物质和NaClO反应制得,该制备反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分其中的编号代表对应的元素.
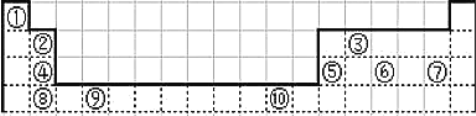
请回答下列问题:
(1)表中属于 ds 区的元素是___________(填元素符号)它的基态原子的价电子排布式为___________。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为____________,其中元素③的基态原子轨道表达式为___________;①和⑥形成的一种常见四原子分子的化学式为___________,它是 _________________(填“极性”、“非极性”)分子。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________;该元素与元素①形成的最简单分子 X 的电子式为___________。
(4)元素⑤的电负性___________④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程________________________。
(6)上表中元素⑤的氢氧化物为两性氢氧化物,请写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表回答问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中______(填元素符号)的非金属性最强;______(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:______。
(2)表中元素③的原子结构示意图是______。
(3)表中元素⑤、⑦的氢化物的稳定性顺序为______>______(填化学式)。
(4)表中元素最高价氧化对应水化物中酸性最强的是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质的化学键有离子键、共价键和_____。
(2)KOCN是离子晶体;碳原子采取sp杂化,1mol该物质中含有的π键数目为____。
(3)H2O2常温下是液体,沸点较高(150℃),其主要原因是____。
(4)非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(5)V2O5溶于NaOH溶液,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为________。
(6)已知食盐的密度为ρ g·cm-3,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA,则在食盐晶体晶胞参数是_______cm。
(7)1 mol SiO2晶体中含________ mol Si—O键。
(8)1 mol NH4BF4含有________ mol配位键。
(9)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:_____________。
(10)体心立方结构的金属如:Na、K、Fe的晶胞的空间占有率表达式为________(含π)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A. 往Na2SiO3溶液中加入盐酸:2Na++ SiO32- +2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
B. 氯气与烧碱溶液反应:Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
C. 稀硫酸滴在铁片上:Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
D. 铜片插入硝酸银溶液中:Cu+Ag+![]() Cu2++Ag
Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2mol/L CuCl2溶液和2mol/L盐酸等体积混合(假设混合后溶液体积等于混合前两种溶液的体积之和)。请计算:
(1)混合液中CuCl2和盐酸的物质的量浓度;_______________
(2)混合液中H+、Cu2+、Cl-的物质的量浓度;______________
(3)向溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时溶液中FeCl2的物质的量浓度。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的合成氨的方法如图所示,下列说法错误的是
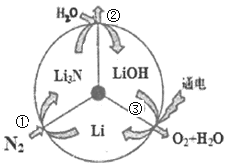
A.反应①属于“氮的固定”
B.反应②属于非氧化还原反应
C.反应③可通过电解LiOH水溶液实现
D.上述三步循环的总反应方程式为2N2+6H2O=4NH3+3O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com