
【题目】如图所示的方案可以降低铁闸门的腐蚀速率。下列判断正确的是( )
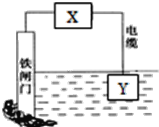
A.若X为导线,Y可以是锌
B.若X为导线,铁闸门上的电极反应式为Fe-2e-=Fe2+
C.若X为直流电源,铁闸门做负极
D.若X为直流电源,Y极上发生还原反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关有机物同分异构体说法中错误的是
A. 三联苯(![]() )的一氯代物有4种
)的一氯代物有4种
B. 立方烷(![]() )经硝化可得到六硝基立方烷,其可能的结构有3种
)经硝化可得到六硝基立方烷,其可能的结构有3种
C. β-月桂烯(![]() )与溴发生1:1加成反应,产物(只考虑位置异构)有3种
)与溴发生1:1加成反应,产物(只考虑位置异构)有3种
D. 酯类化合物C4H8O2在酸性条件下水解得到的醇可能有4种不同结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是![]()
A.金刚石、SiC、NaF、NaCl、![]() 、
、![]() 晶体的熔点依次降低
晶体的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,CaO晶体中![]() 的配位数为6,且这些最邻近的
的配位数为6,且这些最邻近的![]() 围成正八面体
围成正八面体
C.设NaCl的摩尔质量为![]() ,NaCl的密度为
,NaCl的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]()
![]() ,在NaCl晶体中,两个距离最近的
,在NaCl晶体中,两个距离最近的![]() 中心间的距离为
中心间的距离为
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请仔细观察下列几种物质的结构示意图,判断下列说法正确的是
A. 硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为
硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为![]()
B. 锂的某种氧化物晶胞如图所示,则该氧化物的化学式为
锂的某种氧化物晶胞如图所示,则该氧化物的化学式为![]()
C. 某晶体的一部分如图所示,则这种晶体中A、B、C三种粒子数之比是3:9:4
某晶体的一部分如图所示,则这种晶体中A、B、C三种粒子数之比是3:9:4
D. Mn和Bi形成的某种晶体的结构示意图如图所示
Mn和Bi形成的某种晶体的结构示意图如图所示![]() 白球均在六棱柱内
白球均在六棱柱内![]() ,则该晶体物质的化学式为
,则该晶体物质的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
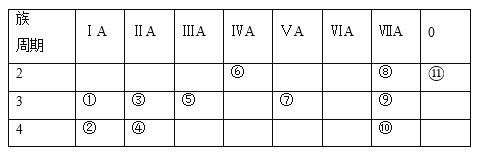
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式__________。
(2)元素④的离子结构示意图为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
①氢气燃烧热值高。实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式正确的是________。
A.H2(g)+![]() O2(g)═H2O(g)△H=+285.8kJ/mol
O2(g)═H2O(g)△H=+285.8kJ/mol
B. H2(g)+![]() O2(g)═H2O(l)△H=﹣285.8kJ/mol
O2(g)═H2O(l)△H=﹣285.8kJ/mol
C. H2(g)+![]() O2(g)═H2O(l)△H=+285.8kJ/mol
O2(g)═H2O(l)△H=+285.8kJ/mol
D. H2+![]() O2═H2O△H=﹣285.8 kJ/mol
O2═H2O△H=﹣285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是______(填“氢气”或“氧气”)。
③氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)2NH3(g) △H=﹣92.4 kJ/mol
反应达到平衡后,升高温度则反应速率_______(填“增大”或“减小”);平衡将向____________(填“正反应方向”或“逆反应方向”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料,以CH4和H2O为原料,通过下列反应来制备甲醇:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0kJmol-1
CO(g)+2H2(g)═CH3OH(g) △H=-129.0kJmol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______。
(2)甲醇对水质会造成一定污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:

①完成除去甲醇的离子方程式:______
Co3++CH3OH+H2O═Co2++……
②若如图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,一定量的Na2C03与盐酸混合所得溶液中,部分含碳微粒的物质的量分数(![]() )与pH的关系如图所示。下列说法正确的是
)与pH的关系如图所示。下列说法正确的是

A. 曲线X表示的微粒为CO32-
B. pH=6.3时,![]() (CO32-)+
(CO32-)+![]() (HCO3-)+
(HCO3-)+![]() (H2CO3)=1.0
(H2CO3)=1.0
C. pH=7时,c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)=c(H+)
D. pH=10.3 时,c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法不正确的是( )
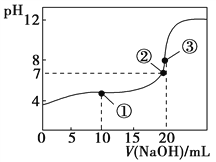
A. 在曲线上任一点均存在:c(Na+)c(OH-) = c(CH3COO-)c(H+)
B. 点①所示溶液中:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+)
C. 点②所示溶液中:c(Na+) = c(CH3COO-)
D. 点③所示溶液中:c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com