
����Ŀ��������ʵ���������ÿ�����þ��Ϊԭ�ϣ���ȡ��������þ(Mg3N2)����֪��һ�����п��ܷ������з�Ӧ��
��2Mg+O2![]() 2MgO ��3Mg+N2
2MgO ��3Mg+N2![]() Mg3N2
Mg3N2
��2Mg+CO2![]() 2MgO+C��Mg+H2O(����)=MgO+H2
2MgO+C��Mg+H2O(����)=MgO+H2
��Mg3N2+6H2O=3Mg(OH)2+2NH3�ɹ�ѡ���������ҩƷ����ͼ��ʾ���Ҽ�����ȷ����ʱ��װ�����������ķ�Ӧ����ȫ�ġ�
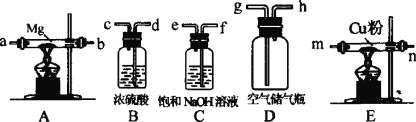
�Իش��������⣺
(1)ʵ�鿪ʼʱ���ȵ�ȼ________װ���еľƾ��ƣ�ԭ����________���ٽ���g���ӵ�����ˮ��ͷ���γ���h�������������������������������ĵ���Ϊ(����ĸ����)��h��________��
(2)���Ƿ�ѡ����Bװ�ã�������ʲô________________________ ��
(3)���Ƿ�ѡ����Cװ�ã�������ʲô________________________��
(4)���ͬʱ��ȼA��Eװ�õľƾ��ƣ���ʵ����������Ӱ��________ Ϊʲô___
���𰸡�E �����Eװ�ó����������л��������� f��e��d��c��m(n)��n(m)��a(b)��b (a) ѡ���Գ�ȥˮ���������ⷴӦ�ܷ��� ѡ���Գ�ȥ�����е�CO2�����ⷴӦ�۷��� ʹ����þ���� ���E�е�ͭ��û�дﵽ��Ӧ�¶�ʱ���������ܳ�������������ͬþ��Ӧ����ʹ����þ�л�������þ
��������
ʵ�������ÿ�����þ��Ϊԭ�ϣ���ȡ��������þ��Mg3N2�������ݿ��ܷ������з�Ӧ����2Mg+O2![]() 2MgO����3Mg+N2
2MgO����3Mg+N2![]() Mg3N2����2Mg+CO2
Mg3N2����2Mg+CO2![]() 2MgO+C����Mg+H2O(����)=MgO+H2����Mg3N2+6H2O=3Mg(OH)2+2NH3�����ø�װ������ȡ����þ��װ�õ���ʵ����ϵþ����������������þ����ˮ��Ӧ�����ʣ���ʵ��Ĺ��̽��������Ϊ��ֹ��Ӧ������þ������һ��Ҫ�ž������еĿ�����Ϊ��ֹ����þ��ˮ�ķ�Ӧ����Ҫ�Ȱ�ͨ��ĵ������
2MgO+C����Mg+H2O(����)=MgO+H2����Mg3N2+6H2O=3Mg(OH)2+2NH3�����ø�װ������ȡ����þ��װ�õ���ʵ����ϵþ����������������þ����ˮ��Ӧ�����ʣ���ʵ��Ĺ��̽��������Ϊ��ֹ��Ӧ������þ������һ��Ҫ�ž������еĿ�����Ϊ��ֹ����þ��ˮ�ķ�Ӧ����Ҫ�Ȱ�ͨ��ĵ������
���ݷ�����֪�����ø�װ������ȡ����þ��װ�õ���ʵ����ϵþ����������������þ����ˮ��Ӧ�����ʣ���ʵ��Ĺ��̽��������Ϊ��ֹ��Ӧ������þ������һ��Ҫ�ž������еĿ�����Ϊ��ֹ����þ��ˮ�ķ�Ӧ����Ҫ�Ȱ�ͨ��ĵ��������
(1)��Ϊ���������ȵ�ͭ��Ӧ������ʵ�鿪ʼʱ���ȵ�ȼEװ���еľƾ��ƣ�ԭ���DZ����Eװ�ó����������л�������������Ϊ��Ҫ�ȳ�������̼���ٳ�ˮ�֣�����������ʽ���g���ӵ�����ˮ��ͷ���γ���h�������������������������������ĵ���Ϊ(����ĸ����)��h��f��e��d��c��m(n)��n(m)��a(b)��b(a)��
(2)ѡ��Bװ�ã����Գ�ȥˮ���������ⷴӦ�ܷ�����
(3)ѡ��Cװ�ã����Գ�ȥ�����е�CO2�����ⷴӦ�۷�����
(4)���ͬʱ��ȼA��Eװ�õľƾ��ƣ���ʵ����������Ӱ��Ϊʹ����þ���������E�е�ͭ��û�дﵽ��Ӧ�¶�ʱ���������ܳ�������������ͬþ��Ӧ����ʹ����þ�л�������þ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĺ����ܱ������з�����Ӧ��2SO2(g)+O2(g)![]() 2SO3(g)������֤����˵����Ӧһ���ﵽ��ѧƽ��״̬����
2SO3(g)������֤����˵����Ӧһ���ﵽ��ѧƽ��״̬����
A.�����ڵ�ѹǿ���ٸı�B.c(SO2)��c(O2)��c(SO3)=2��1��2
C.���������ܶȲ��ٸı�D.SO2������������SO3�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����![]()
A.��ѿ�������ǵ�ˮ�������������ǣ��ʶ��߾�Ϊ��ԭ�Ͷ���
B.�����£���![]() HA��Һ��
HA��Һ��![]() ��Һ��������
��Һ��������![]() ��������ı仯
��������ı仯![]() ��û����Һ��
��û����Һ��![]() ��������Һ����ˮ�������
��������Һ����ˮ�������![]()
C.��̼�²�����̼������ĭ����ÿ����ĭ����Լ4000��̼ԭ�ӣ�ֱ��Լ6��9nm���ڵ���![]() ʱ����ĭ�������ô��ԣ���̼������ĭ����ʯī��Ϊͬ��������
ʱ����ĭ�������ô��ԣ���̼������ĭ����ʯī��Ϊͬ��������
D.��֪![]() ��
��![]() Ϊ
Ϊ![]() ���������
���������![]()
![]() ��
��![]() ��Һ��
��Һ��![]()
![]()
![]() ��Һ��Ϻ����
��Һ��Ϻ����![]() ��������
��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�����ڹ�ҵ��������������;��ij�����Ի�ͭ��(��Ҫ�ɷ�Ϊ Cu2S�������� Fe2O3��SiO2 ������)Ϊԭ���Ʊ�������ˮ�ļ�ʽ̼��ͭ���������£�

��֪��
�ٳ����¼������ʿ�ʼ�γɳ�������ȫ����ʱ��pH���±�
�������� | Fe2�� | Fe3�� | Cu2�� | Mn2�� |
��ʼ���� | 7.5 | 2.7 | 5.6 | 8.3 |
��ȫ���� | 9.0 | 3.7 | 6.7 | 9.8 |
��Ksp[Fe(OH)3]��4.0��10��38
��1���ӿ�����ȡ�����ʣ�������ͭ������⣬���ɲ�ȡ�Ĵ�ʩ��______________________����дһ�֣���
��2����������������ʱ������Լ�A����CuO�ȣ�����pH���ķ�ΧΪ_____________������ A ����Һ�� pH��Ϊ5������Һ�� Fe3����Ũ��Ϊ_____________mol/L��
��3��д����������(�� Mn2��)�����з�Ӧ�����ӷ���ʽ��____________________��
��4�����ϰ���ʱ�������˵IJ���������______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ����ʯ��ϡ���ᷴӦ��ķ�Һ50g����μ���̼������Һ������ʵ���õ����ݻ����ͼ������������m��ʵ��õ��ij�����������������������ʾ����̼������Һ����������˵����ȷ����
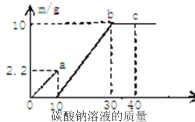
A.ͼ��oa�α�ʾ���ɵij�����
B.c���ʾ̼����ǡ����ȫ��Ӧ
C.��Һ�����������������7.3%
D.��Һ�к��Ȼ���0.1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�к��д���Na+��C1-������Ca2+��Mg2+��SO42-���õ��������Ըú�ˮ��Ʒ���е�������������ͼ��ʾ������˵����ȷ����

A. bĤ�������ӽ���Ĥ
B. A���Ҳ������ݲ�����������������
C. ����������ɺ�A��B��C������pH��СΪpHA<pHB<pHC
D. B���Ҳ����������ʹʪ���KI������ֽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ˮ��Һ��һЩ������ȷ���ǣ� ��
A.ijˮ��Һ�У�c(H+)=![]() mol/L������Һ������
mol/L������Һ������
B.��֪���볣��H2CO3��Ka1=4.2��10-7��Ka2=5.6��10-11��HClO��Ka=2.95��10-8����ͬ�¶���ͬŨ����Һ��pH��Na2CO3<NaClO
C.�����£���Na2S��Һ�м���NaCl��Һ��S2-��ˮ��̶Ȳ���Ӱ��
D.����Cl-��Br-��I-�Ļ����Һ�еμ�AgNO3��Һ���Ȳ�����ɫ������˵��c(I-)���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǣ� ��
A.��NH4Cl������Һ�м������þ���Եõ���������
B.pH=12 Ba(OH)2��Һ��c(OH-)��0.001 mol/L NaOH��Һc(OH-)��10��
C.�����£�CH3COONa��CH3COOH�Ļ����Һ��(pH=7)��c(Na+)=c(CH3COO-)��c(CH3COOH)��c(H+)=c(OH-)
D.�����£�Cd(OH)2��Co(OH)2�Ļ������Һ�У�c(Cd2+)��c(Co2+)��4������֪��Ksp[Cd(OH)2]=7.2��10-15��Ksp[Co(OH)2]=1.8��10-15
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯����������������������Ҫ���ã�
(1)��ͼ��1mol![]() �����1molCO��Ӧ����
�����1molCO��Ӧ����![]() ��NO�����������仯ʾ��ͼ����Ӧ�����зų���������ӦΪ______��
��NO�����������仯ʾ��ͼ����Ӧ�����зų���������ӦΪ______��
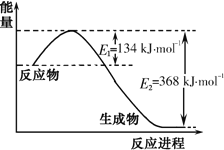
(2)�ڹ̶�������ܱ������У��������»�ѧ��Ӧ��
![]() ��
��![]() ����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| 298 | 398 | 498 |
ƽ�ⳣ��K |
|
|
|
��д���÷�Ӧ��ƽ�ⳣ������ʽ![]() ______��
______��
�����ж�K1______ K2 (��д��![]() ����
����![]() ������
������![]() ��
��![]() ��
��
�����и�����˵���÷�Ӧ�Ѵﵽƽ��״̬����______![]() ����ĸ
����ĸ![]() ��
��
![]() ������
������![]() ��
��![]() ��
��![]() ��Ũ��֮��Ϊ1��3��2
��Ũ��֮��Ϊ1��3��2![]()
![]() ������ѹǿ���ֲ���
������ѹǿ���ֲ��� ![]() ���������ܶȱ��ֲ���
���������ܶȱ��ֲ���
(3)������![]()
![]() �������������ȼ��ʱ����������
�������������ȼ��ʱ����������![]() ��Ӧ����
��Ӧ����![]() ��ˮ������ijͬѧ�����һ��
��ˮ������ijͬѧ�����һ��![]()
![]() ��������ȼ�ϵ�أ����øõ�ص��200mLһ��Ũ��NaCl��
��������ȼ�ϵ�أ����øõ�ص��200mLһ��Ũ��NaCl��![]() �����Һ����װ����ͼ��ʾ��
�����Һ����װ����ͼ��ʾ��
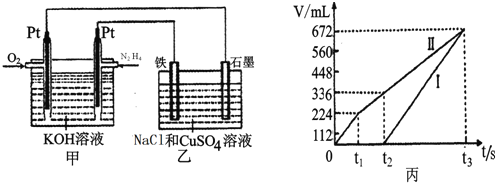
�ٸ�ȼ�ϵ�صĸ�����ӦʽΪ______��
������������������������������ʱ��仯�Ĺ�ϵ���ͼ��ʾ![]() ��������ѻ���ɱ�״���µ����
��������ѻ���ɱ�״���µ����![]() ��д����
��д����![]() ʱ������缫�ϵĵ缫��Ӧʽ______��ԭ�����Һ��NaCl�����ʵ���Ũ��Ϊ______��
ʱ������缫�ϵĵ缫��Ӧʽ______��ԭ�����Һ��NaCl�����ʵ���Ũ��Ϊ______��
����![]() ʱ������Һ��pHΪ______(������Һ�������
ʱ������Һ��pHΪ______(������Һ�������![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com