
【题目】海水是资源宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。完成下列填空:
(1)氯离子原子核外有___种不同运动状态的电子,有___种不同能量的电子,共占据了___个轨道。
(2)溴在周期表中的位置___。HI的稳定性比HBr___(填写“强”或“弱”)。
(3)卤素单质及其化合物在许多性质上都存在递变规律,请说明下列递变规律的原因。
①熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是___。
②还原性按Cl-、Br-、I-的顺序依次增大,原因是___。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是___,氧化产物___。(填离子符号)
(5)HClO有很好的杀菌消毒效果,为增强氯水的杀菌消毒能力,可用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因___。
【答案】18 5 9 第四周期、ⅦA 弱 F2、Cl2、Br2、I2都是分子晶体,相对分子质量依次增大,分子间作用力依次增强 从Cl-、Br-、I-半径依次增大,失电子的能力依次增强,还原性依次增大 2ClO2+2OH-→ClO2-+ClO3-+H2O ClO3- 氯水中存在Cl2+H2O![]() HCl+HClO,加入小苏打,HCl与之反应导致盐酸浓度减小,上述平衡向正向移动,而次氯酸不能与之反应,所以HClO浓度增大
HCl+HClO,加入小苏打,HCl与之反应导致盐酸浓度减小,上述平衡向正向移动,而次氯酸不能与之反应,所以HClO浓度增大
【解析】
(1)氯离子原子核外有18个电子,其电子排布式为1s22s22p63s23p6,共有18种不同的运动状态,有5种不同能量的电子,共占据9个轨道;
(2)溴的核电荷数为35,在周期表中的位置为第四周期、ⅦA,;Br的非金属性比I强,则HI的稳定性比HBr弱;
(3)①F2、Cl2、Br2、I2的相对分子质量逐渐增大,且都属于分子晶体,单质的相对分子质量越大,则熔点越高;
②元素的非金属性越强,对应的阴离子的还原性越强,非金属性Cl>Br>I,Cl-、Br-、I-半径依次增大,失电子的能力依次增强,还原性依次增大;
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,为氧化还原反应,离子反应为2ClO2+2OH-=ClO2-+ClO3-+H2O,Cl元素失去电子被氧化,则氧化产物为ClO3-;
(5)氯水中存在Cl2+H2O![]() HCl+HClO,HCl和与碳酸氢钠反应,而HClO不反应,加入小苏打,盐酸能与之反应导致盐酸浓度下降,平衡向正向移动,而HClO不能与之反应,所以HClO浓度增大。
HCl+HClO,HCl和与碳酸氢钠反应,而HClO不反应,加入小苏打,盐酸能与之反应导致盐酸浓度下降,平衡向正向移动,而HClO不能与之反应,所以HClO浓度增大。


科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是 ( )
2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是 ( )
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开1molH-H键的同时断开2molN-H键
D. 容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究 SO2 气体还原 Fe3+,他们使用的药品和装置如图所示,下列说法不合理的是( )

A.为了验证 A 中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
B.为了验证 A 中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
C.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
D.装置C的作用是吸收SO2尾气,防止污染空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是___,除稀有气体外第三周期中原子半径最小的是____,属于过渡元素的是___(该空格用表中的字母表示)。
(2)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为___。
(3)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验室中四个装置的说明符合实验要求的是
A.若需制备较多量的乙炔可用此装置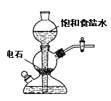
B.可用此装置来制备硝基苯,但产物中可能会混有酸
C.可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘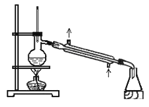
D.可用此装置来制备乙酸乙酯并在烧瓶中获得产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子的浓度为( )。
A.0.1(b-2a) mol·L-1B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1D.10(b-2a) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1) 春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式__________,将54.8g Na2CO3和NaHCO3的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=__,气体V=___。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为_______,若有2mol氯气参与该反应,则此时转移的电子数为___NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为______。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com