
【题目】某有机合成中间体的结构简式如图所示。下列关于该有机物的叙述正确的是( )
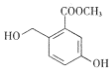
A. 分子式为C9H8O4
B. 1mol该物质最多能与3molBr2发生取代反应
C. 在浓硫酸作用下可发生消去反应
D. 在一定条件下可与HCHO发生缩聚反应
科目:高中化学 来源: 题型:
【题目】乙醇能发生如下反应:
①CH3CH2OH+3O2![]() 2CO2+3H2O;
2CO2+3H2O;
②2Cu+O2 ![]() 2CuO,CH3CH2OH+CuO
2CuO,CH3CH2OH+CuO![]() CH3CHO+H2O+Cu。
CH3CHO+H2O+Cu。
由以上反应不能得出的结论是
A. 由反应①②可知,条件不同,乙醇与O2反应的产物不同
B. 由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C. 由反应①可知,乙醇燃烧时,碳碳键、碳氢键、氢氧键均断裂
D. 由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[![]() ]下列有关LiH2PO4溶液的叙述正确的是
]下列有关LiH2PO4溶液的叙述正确的是


A. 溶液中存在3个平衡
B. 含P元素的粒子有H2PO4–、HPO42–、PO43–
C. 随c初始(H2PO4–)增大,溶液的pH明显变小
D. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用锌和稀硫酸反应制取氢气。在2mol/L的足量稀硫酸跟一定量的锌片反应制取氢气的实验中,为加快反应速率,又不影响生成氢气的总量,可以采用的方法是( )
A.适当升高温度B.加入几滴硫酸铜溶液
C.再加入少量浓硝酸D.加入适量的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X.Y.Z.M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)Z元素是__________,写出Y2+离子的结构示意图_________________,写出单质Y与单质M反应生成物的电子式________________________。
(2)写出单质X与单质M在高温下反应的生成物的化学式为________,该产物分子为________形(填“直线”.平面三角等”),其化学键属________共价键(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝及其氧化物与强碱溶液反应的说法中,正确的是
A. 都有H2O生成
B. 都有H2生成
C. 反应后铝元素主要以AlO2-的形式存在
D. 反应后铝元素主要以Al3+的形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。0.1mol/L的NaHTeO3溶液中,下列粒子的物质的量浓度关系不正确的是( )
A. c(Na+)>c(HTeO3-)>c(OH-)>c(H2TeO3)>c(H+)
B. c(Na+)=c(TeO32-)+c(HTeO3-)+c(H2TeO3)
C. c(Na+)+c(H+)≥c(HTeO3-)+c(TeO32-)+c(OH-)
D. c(H+)+c(H2TeO3)=c(OH-)+c(TeO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
① 写出上述除杂过程中涉及的离子方程式___________、____________。
② AlCl3产品的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com