
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1。则5分钟v(H2O)=_______________,CO的转化率α(CO)=___________。
(4)将合成气以![]() =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
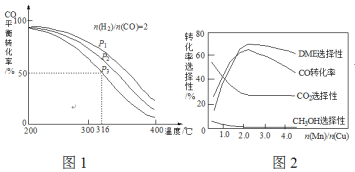
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃时,起始时![]() =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中![]() 约为___________时最有利于二甲醚的合成。
约为___________时最有利于二甲醚的合成。
【答案】-246.1 K12·K2·K3 AC 0.003 15 % AB 2.0(2-3之间即可)
【解析】
(1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;根据盖斯定律,将已知的热化学方程式叠加,可得到待求的反应的热化学方程式及其反应热;
(2)提高CH3OCH3产率,改变条件应使平衡正向移动,结合平衡移动原理分析解答;
(3)根据物质转化关系,结合平衡时H2的含量,计算反应消耗的H2O、CO的物质的量,然后根据物质反应速率和转化率的含义计算;
(4)A.根据压强一定时,随温度升高CO的转化率减小判断反应的热效应;
B.根据温度不变时CO的转化率遇压强的关系判断几个反应的压强大小;
C.增大氢气的用量,平衡正向移动,CO的转化率增大;
(5)CO的转化率最大,生成二甲醚的选择性最大时最好。
(1)①CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
根据盖斯定律,①×2+②+③得3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=-246.1kJ/mol;该反应是①×2+②+③叠加而来,根据化学平衡常数的含义可知K= K12·K2·K3;
CH3OCH3(g)+CO2(g) △H=-246.1kJ/mol;该反应是①×2+②+③叠加而来,根据化学平衡常数的含义可知K= K12·K2·K3;
(2)A.增大反应物的浓度平衡正移,更多的CH3OCH3生成,能提高CH3OCH3产率,A正确;
B.该反应的正反应为放热反应,升高温度平衡逆向移动,则CH3OCH3产率会降低,B错误;
C.该反应正方向为气体体积减小的方向,所以增大压强平衡正移,能提高CH3OCH3产率,C正确;
故合理选项是AC;
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③CO(g)+H2O(g)![]() CO2(g)+H2(g),5分钟时达到化学平衡,假设反应的CO的物质的量为x,则平衡时各种气体物质的量分别是n(CO)=(0.2-x)mol,n(H2O)=(0.01-x)mol,n(H2)=n(CO2)=xmol,由于该反应是反应前后气体体积相等的反应,所以平衡后混合气体的物质的量n(总)=0.2mol+0.1mol=0.3mol,测得H2的体积分数为0.1,则n(H2)=0.1×(0.2+0.1)mol=0.03mol,则5分钟 时△n(H2O)=△n(CO)=0.03mol,所以v(H2O)=
CO2(g)+H2(g),5分钟时达到化学平衡,假设反应的CO的物质的量为x,则平衡时各种气体物质的量分别是n(CO)=(0.2-x)mol,n(H2O)=(0.01-x)mol,n(H2)=n(CO2)=xmol,由于该反应是反应前后气体体积相等的反应,所以平衡后混合气体的物质的量n(总)=0.2mol+0.1mol=0.3mol,测得H2的体积分数为0.1,则n(H2)=0.1×(0.2+0.1)mol=0.03mol,则5分钟 时△n(H2O)=△n(CO)=0.03mol,所以v(H2O)=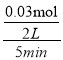 =0.003mol/(Lmin),CO的转化率α(CO)=
=0.003mol/(Lmin),CO的转化率α(CO)=![]() ×100%=15%;
×100%=15%;
(4)A.由图可知,压强一定时,随温度升高CO的转化率减小,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,A正确;
B.正反应为气体体积减小的反应,增大压强平衡正向移动,CO的转化率增大,所以P1>P2>P3,故B错误;
C.若在P3和316℃时,起始时![]() =3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%,C错误;
=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%,C错误;
故合理选项是AB;
(5)由图可知当催化剂中![]() 约为2.0时,CO的转化率最大,生成二甲醚的最多。
约为2.0时,CO的转化率最大,生成二甲醚的最多。


科目:高中化学 来源: 题型:
【题目】现有一定量的镁铝合金与![]() 稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入
稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入![]() NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
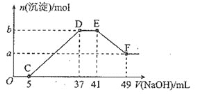
A.![]()
B.OC段反应的离子方程式为![]()
C.D点对应溶液中的溶质为![]() 和
和![]()
D.原![]() 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碱性丙烷燃料电池电解苦卤水![]() 含
含![]() 、
、![]() 、
、![]() 、
、![]() 的装置如图所示
的装置如图所示![]() 、b为石墨电极
、b为石墨电极![]() ,下列说法正确的是( )
,下列说法正确的是( )
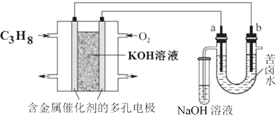
A.电池工作时,负极反应式为:![]()
B.电解时,a电极周围首先放电的是![]() 而不是
而不是![]() ,说明当其他条件相同时后者的还原性强于前者
,说明当其他条件相同时后者的还原性强于前者
C.电解时,电子流动的路径是:负极![]() 外电路
外电路![]() 阴极
阴极![]() 溶液
溶液![]() 阳极
阳极![]() 正极
正极
D.忽略能量损耗,当电池中消耗16gO2时,a极周围会产生0.71gCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PI3)引用作新敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成。回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) △H1。
CH3NH2(g)+H2O(g) △H1。
①NH3电子式为_______。
②已知该反应中相关化学键的键能数据如下:

则该反应的△H1=_______kJ·mol-1
(2)上述反应中所需的甲醇可以利用甲烷为原料在催化剂作用下直接氧化来合成。煤炭中加氢气可发生反应:C(s)+2H2(g)![]() CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。
CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。

①该反应的△H2_______0(填“>” 、“<”或“=”),判断理由是_______。
②在4MPa、1100K时,图中X点v正(H2)____ v逆(H2)(填“>”、“<”或“=”)。该条件下,将1molC和2molH2通入密闭容器中进行反应,平衡时测得的转化率为80%,CH4的体积分数为______。若维持容器体积不变,向其中再加入0.5mo1C和1mo1H2,再次达到平衡后,平衡常数K_____(填“增大”、“减小”或“不变”)。
③某化学兴趣小组提供下列四个条件进行上述反应,比较分析后,你选择的反应条件是______(填字母序号)。
A.5MPa 800K B.6MPa 1000K C.10MPa 1000K D.10MPa 1100K
(3)已知常温下PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,Pb(NO3)2溶液与KI溶液混合可形成PbI2沉淀。现将浓度为2×10-3mol·L-1的Pb(NO3)2溶液与一定浓度的KI溶液等体积混合,则生成沉淀所需KI溶液的最小浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有一滴KMnO4;电源有a、b两极。若在A、B中充满0.01 mol/L 的KOH溶液后倒立于同浓度的KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如下图所示,则:
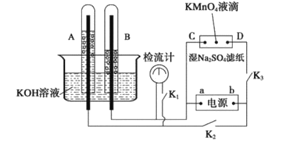
(1)断开K1,闭合K2、K3,通直流电,试管B中产生的气体为_________(填化学式)。
(2)在Na2SO4溶液浸湿的滤纸条中部的KMnO4处现象为_____________。
(3)断开K1,闭合K2、K3,通直流电较长一段时间后,KOH溶液pH变__________(填“变大”“变小”或“不变”)。
(4)电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计有指数,此时该装置A试管中电极上发生的反应为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某有机化合物的结构简式:
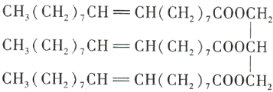
请回答下列问题。
(1)该有机化合物含有的官能团有_______________(填名称)。
(2)该有机化合物的类别是_______________(填字母序号,下同)。
A.烯烃 B.酯 C.油脂 D.羧酸
(3)将该有机化合物加入水中,则该有机化合物_______________。
A.与水互溶 B.不溶于水,水在上层 C.不溶于水,水在下层
(4)该物质是否有固定熔点、沸点?_______________(填“是”或“否”)
(5)能与该有机化合物反应的物质有_______________。
A.![]() 溶液 B.碘水 C.乙醇 D.乙酸 E.
溶液 B.碘水 C.乙醇 D.乙酸 E.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___molL1min1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
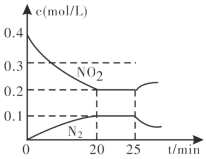
A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业可由异丙苯(![]() )催化脱氢得到2-苯基丙烯(
)催化脱氢得到2-苯基丙烯(![]() ),下列关于两种有机物说法正确的是( )
),下列关于两种有机物说法正确的是( )
A.都是苯的同系物
B.都能使酸性KMnO4溶液褪色
C.苯环上的二氯代物都有6种
D.分子内共平面最多的碳原子数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述一定正确的是
为阿伏加德罗常数的值,下列叙述一定正确的是![]()
![]()
A.在![]() 数目为
数目为![]() 的
的![]() 溶液中,
溶液中,![]() 总数为
总数为![]()
B.![]() 稀硝酸与Fe完全反应
稀硝酸与Fe完全反应![]() 还原产物只有
还原产物只有![]() ,转移电子的数目为
,转移电子的数目为![]()
C.![]() 与
与![]() 在催化剂的作用下加热充分反应,所得NO的分子数为
在催化剂的作用下加热充分反应,所得NO的分子数为![]()
D.![]() 的硫酸溶液中含有
的硫酸溶液中含有![]() 的数目为
的数目为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com