
【题目】关于Na2CO3和NaHCO3的说法正确的是
A.它们的物质的量相等时,跟足量的盐酸反应,在相同状况时放出的CO2体积相同
B.它们的物质的量相等时,跟足量的盐酸反应,所消耗盐酸的物质的量相同
C.它们的质量相等时,在水中电离出相同数目的Na+
D.它们的质量相等时,与足量盐酸反应产生物质的量相等的CO2
【答案】A
【解析】
A.它们的物质的量相等时,跟足量的盐酸反应,反应后都生成二氧化碳,根据C元素守恒可知,生成二氧化碳体积相同,故A正确;
B.根据Na元素守恒,物质的量相等的碳酸钠和碳酸氢钠,与盐酸反应后都生成NaCl,则碳酸钠消耗的盐酸多,故B错误;
C.Na2CO3=2Na++CO32,NaHCO3=Na++HCO3,设它们的质量相等时都是1g,物质的量分别为:![]() 和
和![]() ,在水中电离出的Na+离子的物质的量为:
,在水中电离出的Na+离子的物质的量为:![]() 和
和![]() ,数目不同,故C错误;
,数目不同,故C错误;
D.它们的质量相等时,碳酸钠和碳酸氢钠的摩尔质量不相等,它们的物质的量不相等,与足量盐酸反应后都生成二氧化碳,根据C元素守恒可知,生成CO2的物质的量不相等,故D错误;
答案选A。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
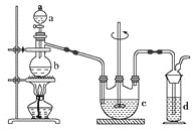
回答下列问题:
(1)a中试剂为__________,b中试剂为__________,c中试剂为____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是______________。
(3)d中的试剂为__________________。
(4)实验中要控制SO2生成速率,可以采取的措施有________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,化学宝验室产生的废液必须经处理后才能排放。某化学实验室产生的酸性废液中含有Fe3+、Cu2+、Ba2+三种金属阳离子和Cl-种阴离子,实验室设计了下述方案对废液进行处理,以回收金属并测定含量,保护环境。
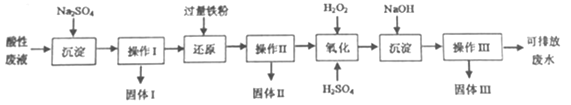
已知实验中处理的酸性废液的体积为IL,用pH计测定出其中H+物质的量浓度为0.10mol·L-1.
请回答下列问题:.
(1)实验中操作I、II、III的方法相同,操作步骤依次为过滤、_________、干燥。
(2)“氧化”步骤所得溶液颜色为棕黄色,该反应的离子方程式为:_________
(3)检验可排放的废水中不含Fe3+的方法是:_________
(4)实验中称量固体I的质量为4.66g,固体II的质量为15.2g,用足量的稀硝酸溶解固体II后产生了标准状况下的无色气体4.48L,则固体II中金属铜的质量为_________
(5)实验中将固体II进行充分灼烧,使用仪器除了酒精灯、三脚架、泥三角、玻璃棒外,还有_________(填名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol·L-1 NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用导率传感器绘制电导率曲线如图所示(电导率的物理意义是表示物质导电的性能)。下列有关叙述错误的是( )

A. 曲线I为盐酸,曲线Ⅱ为醋酸溶液
B. a点、c点均为滴定终点
C. c点:c(Na+) > c(A-) > c(H+) > c(OH-)
D. b点pH值大于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。
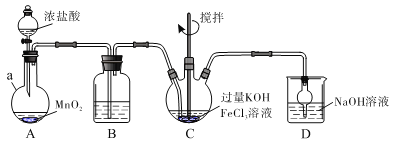
(1)仪器a的名称是____________,装置B中除杂质所用试剂是__________,装置D的作用是________________。
(2)A中发生反应的化学方程式为___________________________________。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为______,反应中KOH必须过量的原因是_____________________。
(4)写出C中总反应的离子方程式:__________________。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O![]() ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 (NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 (NH4)2Fe(SO4)2标准溶液28.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为__________。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_______(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物命名正确的是( )
A.![]() 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯
B.![]() 3-甲基丁酸
3-甲基丁酸
C.CH3CH(C2H5)CH2CH2CH32-乙基戊烷
D.![]() 2-羟基丁烷
2-羟基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由p(丙烯)制备化合物r(丙烯酸甲酯)的流程如图:
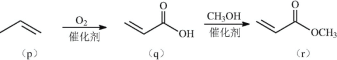
下列说法正确的是( )
A.只有p能发生加聚反应
B.p、q分子中所有原子均可处于同一平面
C.可用![]() 溶液鉴别q和r
溶液鉴别q和r
D.与r含有相同官能团的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作正确且能达到预期目的的是
A.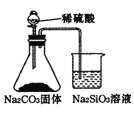 证明碳酸酸性强于硅酸
证明碳酸酸性强于硅酸
B.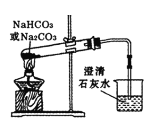 比较NaHCO3和Na2CO3热稳定性
比较NaHCO3和Na2CO3热稳定性
C.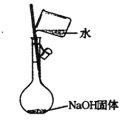 配制0.1mol·L-1NaOH溶液
配制0.1mol·L-1NaOH溶液
D.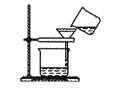 除去粗盐溶液中的泥沙
除去粗盐溶液中的泥沙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com