
【题目】下列图中的实验方案,能达到实验目的的是( )
实验方案 | 实验目的 | |
A |
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
| 制备Fe(OH)2并能较长时间观察其颜色 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】对于硫酸和硝酸的比较中,下列叙述不正确的是
A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
B.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性
C.稀硫酸和稀硝酸都具有氧化性
D.硫酸和硝酸都是重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、R、Y、Z、M为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示,R的原子序数大于Z。下列说法错误的是
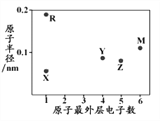
A. R的氧化物只含有离子键
B. 最高价含氧酸的酸性:Y<M
C. 最简单氢化物的稳定性:Y<Z
D. Z的简单氢化物可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氯气可用于合成药物B.SO2环境污染大,工业生产中没有价值
C.纯碱在造纸工业中有着重要的应用D.硫酸铜可作泳池池水消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与水的反应可表示为:3NO2+H2O=2HNO3+NO,关于此反应中的下列说法正确的是( )
A.氮元素的化合价没有发生变化
B.NO2只是氧化剂
C.NO2只是还原剂
D.NO2既是氧化剂,又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是
(2)XY2﹣离子的立体构型是;R2+的水合离子中,提供孤电子对的原子是 .
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是 . 
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
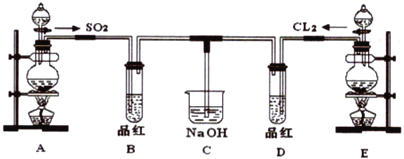
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_________________________________________。
(2)实验室用装置E制备Cl2,其反应化学化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①指出该反应中在反应中HCl(浓)所表现出的化学性质_____________、___________。
②请把(2)中的化学方程式改写为离子方程式_______________________________________。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象(填选项,下同。
A.品红都褪色 B.品红都不褪色
C.试管B 中品红褪色D 中不褪色 D.试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为__________。
A.无色 红色 B.无色 无色 C.红色 红色 D.红色 无色
(4)C 烧杯氢氧化钠溶液的作用是________________________。
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO﹣+H2OCH3COOH+OH﹣ , 使得溶液中的c(OH﹣)>c(H+)
B.在常温下,10 mL 0.2 molL﹣1盐酸与10 mL 0.2 molL﹣1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13
C.在0.1 molL﹣1 NH4Cl溶液中:c(H+)+c(NH4+=c(Cl﹣)
D.5 mL 1 molL﹣1 CH3COONa溶液与5 mL 1 molL﹣1盐酸混合液中c(Cl﹣)=c(Na+)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国产铜主要取自黄铜矿(CuFeS2),湿法炼铜工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为________________________________.
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为__________________________________________________
Ⅱ,配位浸出
反应原理为:CuFeS2+NH3·H2O+O2+OH-→ Cu(NH3)42++Fe2O3+SO42-+H2O(未配平)
(2)用化学用语解释氨水溶液的酸碱性______________________________.
(3)生产中为了稳定溶液的pH,可以在浸出液加入___________________(物质名称)Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
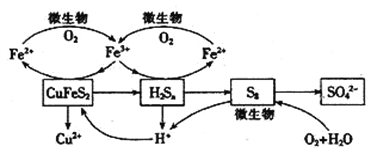
(4)在微生物的作用下,可以循环使用的物质有_________(填化学式),微生物参与的离子反应方程式为_______________________________(任写一个)。
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com