
【题目】今年是俄罗斯化学家门捷列夫提出“元素周期律”150周年。门捷列夫为好几种当时尚未发现的元素(如“类铝”“类硅”和“类硼”)留下了空位。而法国科学家在1875年研究闪锌矿(ZnS)时发现的“镓”,正是门捷列夫预言的“类铝”,其性质也是和预言中的惊人相似。请回答下列问题:
(1)①基态镓原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形;门捷列夫预言的“类硼”就是现在的钪,“类硅”即是现在的锗。在镓、钪、锗三种元素的原子中,未成对电子数最多的是_________ (填元素符号)。
②下列说法中,最有可能正确的一项是_________(填字母代号)。
A 类铝在100℃时蒸气压很高 B 类铝的氧化物一定不能溶于强碱溶液
C 类铝一定不能与沸水反应 D 类铝能生成类似明矾的矾类
(2)氯化镓晶体熔点为77.9℃。氯化镓分子中镓的杂化方式为_______,空间构型为_______;写出与氯化镓互为等电子的的分子、离子各一种:_______、_______。
(3)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,GaN、GaP、GaAs晶体的熔点如下表所示,分析其变化原因:__________________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(4)2011年,我国将镓列为战略储备金属,我国的镓储量约占世界储量的80%以上。砷化镓也是半导体材料,其结构与硫化锌类似,其晶胞结构如下图所示:

①原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中A(0,0,0)、B(![]() )、C(1,
)、C(1,![]() ,
,![]() ),则此晶胞中,距离A球最远的黑球的坐标参数为______________。
),则此晶胞中,距离A球最远的黑球的坐标参数为______________。
②若砷和镓的原子半径分别为a cm和b cm,砷化镓的摩尔质量为M g/mol,密度为![]() g/cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为_________ (用含a、b、M、
g/cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为_________ (用含a、b、M、![]() 、NA的代数式表示,NA表示阿伏加德罗常数的值)。
、NA的代数式表示,NA表示阿伏加德罗常数的值)。
【答案】15 纺锤 Ge D sp2 平面正三角形 BCl3(或BF3) NO3-(或CO32-)(其他答案合理也可给分) GaN、GaP、GaAs都是原子晶体,原子半径N<P<As,键长Ga—N<Ga—P<Ga—As,键能Ga—N>Ga—P>Ga—As,故熔点依次降低 (![]() ,
, ![]() ,
, ![]() )
) ![]()
【解析】
(1)①根据同一轨道的2两个电子自旋方向相反判断。镓的最高能级为4p,p轨道电子云轮廓图为纺锤形,通过电子排布式判断未成对电子数目;
②“类铝”性质和铝相似;
(2)可结合孤对电子、价层电子对数来判断杂化方式与空间构型。等电子体是指价电子总数和原子总数相同的分子、离子或原子团;
(3)晶体硅是原子晶体,则GaN、GaP、GaAs都是原子晶体,原子半径越小,键能越大,熔点越高;
(4)①晶胞中距离A球最远的黑球与A球的连线处于晶胞体对角线上,根据几何原理,二者距离等于体对角线长度的;
②晶胞中原子体积占空间体积百分率=![]() 。
。
(1)①镓是31号元素,核外有31个电子,基态镓(Ga)原子的电子排布式为1s22s22p63s23p63d104s24p1,由泡利原理可知,基态镓原子中,核外存在15对自旋相反的电子。核外电子占据的最高能级为4p,电子云轮廓图为纺锤形。镓中有一个未成对电子,钪原子的电子排布式为1s22s22p63s23p63d14s2,钪中有一个未成对电子,锗原子的电子排布式为1s22s22p63s23p63d104s24p2,锗中有两个未成对电子,在镓、钪、锗三种元素的原子中,未成对电子数最多的是Ge;
②A. 固体的蒸气压一般比较小,类铝在100℃时蒸气压应该不是很高,故A错误;
B. 氧化铝溶于碱,类铝的氧化物也可以溶于强碱,故B错误;
C.类铝的金属性比Al强,Al能与沸水反应,类铝与沸水反应,故C错误;
D. 类铝与铝的结构相似,能生成类似明矾的矾类,故D正确,
答案选D;
(2)氯化镓分子中镓没有孤电子对,价层电子对数为3,中心原子杂化方式为sp2,空间构型为平面正三角形。等电子体是指价电子总数和原子总数相同的分子、离子或原子团,与氯化镓互为等电子的的分子、离子有BCl3(或BF3)、NO3-(或CO32-);
(3)晶体硅是原子晶体,则GaN、GaP、GaAs都是原子晶体。由表可知,GaN、GaP、GaAs晶体的熔点依次减小,因为GaN、GaP、GaAs都是原子晶体,原子半径N<P<As,键长Ga—N<Ga—P<Ga—As,键能Ga—N>Ga—P>Ga—As,故熔点依次降低;
(4)①晶胞中距离A球最远的黑球与A球的连线处于晶胞体对角线上,根据几何原理,二者距离等于体对角线长度的,该黑色球距离各坐标平面距离均为晶胞棱长的,由坐标参数可知晶胞棱长为1,故该黑色球到各坐标平面的距离均为,故该黑色球的坐标参数为(![]() ,
, ![]() ,
, ![]() );
);
②设阿伏加德罗常数为![]() ,晶胞中Ga原子数目
,晶胞中Ga原子数目![]() ,As原子数目
,As原子数目![]() ,晶胞相当于有4个“GaAs”,晶胞质量
,晶胞相当于有4个“GaAs”,晶胞质量![]() ,晶胞中Ga、As原子总体积
,晶胞中Ga、As原子总体积![]() ,则晶胞的体积为
,则晶胞的体积为![]() cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为
cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为![]() 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A. CH3COOH溶液中加入少量CH3COONa固体,溶液的pH值升高
B. 浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)- c(CH3COOH)=2[c(H+)-c(OH-)]
C. 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/ c(H+)减小
D. 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家研发了一种能量转化装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )

A.该装置将太阳能直接转化为化学能
B.离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的pH不变
D.Y电极的反应:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甘油酯GMA(![]() ),由于本身带有丙烯酸酯双键和环氧基团,使得其应用十分广泛。工业合成GMA的一种方法如图(部分反应所需试剂和条件已略去):
),由于本身带有丙烯酸酯双键和环氧基团,使得其应用十分广泛。工业合成GMA的一种方法如图(部分反应所需试剂和条件已略去):
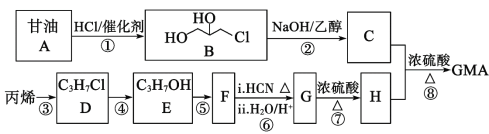
已知:
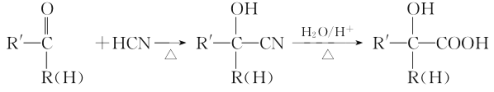
请按要求回答下列问题:
(1)B中的官能团名称:__;
(2)C的结构简式__;
(3)请写出E→F的反应方程式和反应类型:E→F:__,__反应;
(4)H的核磁共振氢谱峰面积之比由大到小为__,H的同分异构体中能发生水解反应的链状化合物有__种。
(5)已知:CH2=CH2![]()
![]() 。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:
。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:![]()
![]() __。
__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac +CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①写出铜原子的价电子轨道表示式_________。
②氨分子的空间构型为_________;氨气极易溶于水是因为_________;氨水中各元素原子的电负性从大到小排列顺序为_________。
③醋酸分子中,碳原子的杂化方式是___________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________。
a 离子键b 配位键c σ键d π键
(2)某离子型氢化物化学式为XY2,晶胞结构如图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
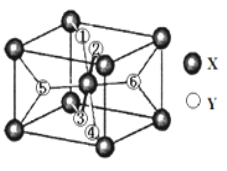
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞__________。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是_______。
a XY2晶体>硅烷晶体>固态氨 b XY2晶体>固态氨>硅烷晶体
c 固态氨>硅烷晶体>XY2晶体 d 硅烷晶体>固态氨>XY2晶体
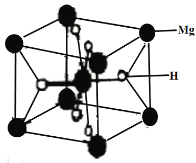
(3)MgH2是金属氢化物储氢材料,其晶胞如下图所示,该晶体的密度为agcm-3,则晶胞的体积为___________cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类应用较早,当前应用量最大的金属元素。下列有关说法中正确的是( )
A.人类使用铁制品在铝之后
B.常温下,铁不能与浓硝酸反应
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入适量氯水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( )

A. 正极反应为:3O2+12e-+4Al3+=2Al2O3
B. 传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外电路转移0.01mol电子,消耗O2的体积为0.56L
D. 给传感器充电时,Ag+向多孔石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiS 可用作陶瓷和搪瓷的着色剂。NiS 在有水存在时能被氧气氧化成Ni(OH)S。将H2S通入稀硫酸酸化的NiSO4溶液中,经过过滤,制得NiS 沉淀,装置如图所示:

下列对实验的叙述正确的是
A. 在装置A中滴加蒸馏水前通入N2,是为了将H2S赶入C 装置中与NiSO4溶液反应
B. 装置B 中盛放浓硫酸
C. 装置D 中的洗涤液应用煮沸过的蒸馏水
D. 反应结束后继续通入N2 可将C装置中产生的沉淀压入过滤沉淀漏斗中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com