
����Ŀ������ﮣ�LiMn2O4)����������ӵ�س��õ��������ϡ���ҵ�������̿�Ϊԭ�Ͽ��Ʊ�����ﮣ�ͬʱ�Ƶø���ƷMnSO4��H2O���壬��������ͼ��ʾ��
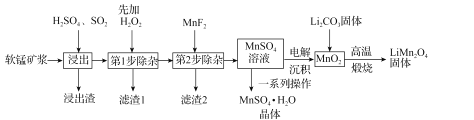
��֪����1�����̿���Ҫ�ɷ�ΪMnO2��������Fe2O3��MgO��Al2O3��CaO��SiO2�����ʡ�
��2���¶ȸ���27��ʱ��MnSO4������ܽ�����¶����߶����͡�
��3���й����ʵ��ܶȻ��������±���
��1����������������MnO2ת��ΪMn2+�����ӷ���ʽΪ_____���ù����У�Ϊ������̿���MnO2�Ľ����ʣ����д�ʩ���е���_____������ĸ����
A�����Ͻ��裬ʹSO2�����̿�ֽӴ�
B������ͨ��SO2������
C���ʵ�����
D���������̿Ľ�����
��2����1�������м���H2O2��Ŀ����_____��
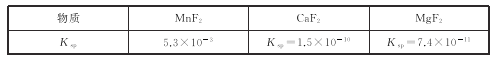
��3����2�����ӣ���Ҫ�ǽ�Ca2+��Mg2+ת��Ϊ��Ӧ�ķ����������ȥ������MnF2��ȥMg2+��Ӧ�����ӷ���ʽΪMnF2(s)+Mg2+(aq)=Mn2+(aq)+MgF2(s)���÷�Ӧ��ƽ�ⳣ��Ϊ_____��
��4��ͼ�е�һϵ�в���ָ����_____��
��5����MnO2��Li2CO3��4��1�����ʵ���֮�����ϣ���Ͻ��裬Ȼ���������600~750�棬��ȡ��ƷLiMn2O4��д���÷�Ӧ�Ļ�ѧ����ʽ��_____��
���𰸡�MnO2+ SO2= SO42-+ Mn2+ AC ��Fe2+����ΪFe3+ 7.2��107 ����Ũ�������ȹ��� 8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2��+O2��
4LiMn2O4+2CO2��+O2��
��������
(1) MnO2��SO2����������ԭ��Ӧ��ת��ΪMn2+��MnO2�Ľ����ʸ��ݷ�Ӧ���������
(2) H2O2 ���������ԣ������ɷ�����
(3) MnF2��ȥMg2+�����ӷ�Ӧ����ʽ��MnF2+ Mg2+![]() Mn2++ MgF2���÷�Ӧ��ƽ�ⳣ����ֵΪ
Mn2++ MgF2���÷�Ӧ��ƽ�ⳣ����ֵΪ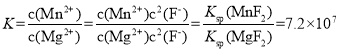 ��
��
(4) MnSO4������ܽ�����¶����߶����ͣ�Ҫע��������
(5) MnO2��Li2CO3��һ���¶��·�����Ӧ������LiMn2O4��CO2��O2���ݴ˷������
(1)��������������MnO2��SO2����������ԭ��Ӧ��ת��ΪMn2+�����ӷ���ʽΪMnO2+ SO2= SO42-+ Mn2+�� MnO2�Ľ����ʣ�A�����Ͻ��裬ʹSO2�����̿�ֽӴ�������SO2�ͻ����ת��ΪSO42-��A����ȷ��
B������ͨ��SO2�����٣����ܻᵼ�²���SO2δ���ü���Ӧ���ݳ������ʵIJ��ʽ��ͣ�B�����
C���¶����ߣ�����������ӦЧ�ʣ�C����ȷ��
D���������̿Ľ�������SO2���ܲ��ܼ�ʱ�μӷ�Ӧ�����»����ʽ��ͣ�D����ʺ���ѡ����AC���ʴ�ΪMnO2+ SO2= SO42-+ Mn2+��AC��
(2)��1�������м���H2O2��Ŀ���ǽ���Һ�е�Fe2+����ΪFe3+���Ա����γ�Fe(OH)3���������˽�������ȥ���ʴ�Ϊ����Fe2+����ΪFe3+��
(3)MnF2��ȥMg2+�����ӷ�Ӧ����ʽ��MnF2+ Mg2+![]() Mn2++ MgF2���÷�Ӧ��ƽ�ⳣ����ֵΪ
Mn2++ MgF2���÷�Ӧ��ƽ�ⳣ����ֵΪ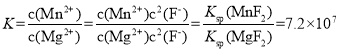 ���ʴ�Ϊ��7.2��107��
���ʴ�Ϊ��7.2��107��
(4)��Һ�����壬ͬʱMnSO4��H2O��ˮ�е��ܽ�����¶ȵ����߶���С����������Ũ�������ȹ��˲������ʴ�Ϊ������Ũ�������ȹ��ˣ�
(5) MnO2��Li2CO3��Ӧ��ֻ��Mn�ļ�̬���ͣ���Ȼ��Ԫ�صĻ��ϼ����ߣ�CԪ�ش������̬���������ߣ���ֻ����OԪ�ؼ�̬���ߣ����Ի���O2���ɡ����ݵ����غ㡢ԭ���غ㣬�ɵø÷�Ӧ�ķ���ʽΪ��8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2��+O2�����ʴ�Ϊ��8MnO2+2Li2CO3
4LiMn2O4+2CO2��+O2�����ʴ�Ϊ��8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2��+O2����
4LiMn2O4+2CO2��+O2����


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���������ȷ���ǣ� ��
A.���ķ���ʽΪC6H6��������ʹ����KMnO4��Һ��ɫ�����ڱ�����
B.�ӱ��Ŀ�����ʽ(![]() )�����������к���̼̼˫����Ӧ����ϩ��
)�����������к���̼̼˫����Ӧ����ϩ��
C.�ڴ��������£�����Һ�巴Ӧ�����屽�������˼ӳɷ�Ӧ
D.������Ϊƽ���������νṹ��6��̼ԭ��֮��ļۼ���ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�ʵ����Ϣ���£�
ʵ���� | c(HA)/ mol��L��1 | c(NaOH)/ mol��L��1 | ��Ӧ����ҺpH |
�� | 0.1 | 0.1 | pH��9 |
�� | c1 | 0.2 | pH��7 |
�����жϲ���ȷ����
A.c1һ������0.2 mol��L��1
B.HA�ĵ��뷽��ʽ��HA![]() H����A��
H����A��
C.��Ӧ����Һ�У�c(Na��) �� c(OH��)�� c(A��) �� c(H��)
D.�ҷ�Ӧ����Һ�У�c(Na��) �� c(HA)��c(A��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з������ʵķ�ˮ��Դ�㷺��Σ���ϴ��ӷ�ˮ������������ˮ�壬��Σ��ˮ������ķ�ֳ�����棻����ˮ���ӣ���Ӱ�����彡����ij���нṹ�о���һ�ָ�Ч�����BMO��Bi2MoO6)�������ڹ�����ⶡ���ӣ�ԭ����ͼ��ʾ������˵��������ǣ� ��
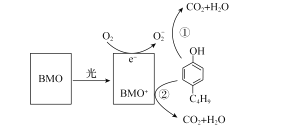
A.�����BMO�ɽ��Ͷ�����������Ӧ����H
B.�ڶ���������������BMO���ֳ�ǿ��ԭ��
C.����������һOH��һC4H9��ͬ���칹�干��12�֣������������칹��
D.��Ӧ��BMO���뷴Ӧ�����ҿ���ѭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������仯����Ի�����������Ҫ���塣
��1����֪��
��N2(g)+O2(g)=2NO(g) ��H1
��2NH3(g)![]() N2(g)+3H2(g) ��H2
N2(g)+3H2(g) ��H2
��2H2(g)+O2(g)=2H2O(g) ��H3
���Ȼ�ѧ����ʽ��4NH3(g)+6NO(g)=5N2(g)+6H2O(g)��H=_____������H1����H2����H3��ʾ����
��2����2L�ܱվ��������У�Ͷ��4molN2��6molH2����һ������������NH3����ò�ͬ�¶��£�ƽ��ʱNH3�����ʵ����������±���
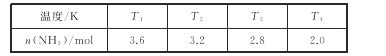
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����_____��
A.3v��(H2)=2v��(NH3)
B.����������ѹǿ����
C.���������ܶȲ���
D.��������¶ȱ��ֲ���
���¶�T1_____(����>��<������=����T3��
����T4�¶��£��ﵽƽ��ʱN2��ת����Ϊ_____��
��3��N2O4Ϊ��Ҫ�Ļ���ƽ���֮һ��N2O4��NO2ת�����Ȼ�ѧ����ʽΪN2O4(g)=2NO2(g) ��H��������Ӧ�У�����Ӧ����v��=k����p(N2O4)���淴Ӧ����v��=k����p2(NO2)������k����k��Ϊ���ʳ�������÷�Ӧ�Ļ�ѧƽ�ⳣ��KpΪ____����k����k����ʾ��������һ����N2O4Ͷ����������к��º�ѹ�ֽ⣨�¶�298K��ѹǿ110kPa)����֪��������k��=5��102kPa-1��s-1����N2O4�ֽ�10%ʱ��v��=_____kPa��s-1��
��4����������������(S2O42-)Ϊ��ԭ���ѳ������е�NO����ͨ�����������װ����ͼ�������ĵ缫��ӦʽΪ_____�������еĸ�ĤΪ_____�����������������������ӽ���Ĥ��ÿ����1molNO����·��ͨ�����ӵ����ʵ���Ϊ_____��
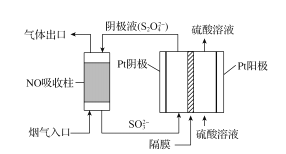
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ���������ܴ����������(����)
A.��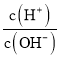 ��1013����Һ�У�NH4+��Ca2����Cl-��K��
��1013����Һ�У�NH4+��Ca2����Cl-��K��
B.��ˮ�������c(H+)=1��10��13mol/L����Һ�У�Na����HCO3-��Cl-��K��
C.��ɫ��Һ�п��ܴ�������Al3+��NH4+��Cl-��S2-
D.������Һ�п��ܴ�������Fe3+��K+��Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0��10mol��L��1NaOH��Һ�ֱ�ζ�20��00mLŨ�Ⱦ�Ϊ0��10 mol��L��1CH3COOH
��Һ��HCN��Һ���õζ���������ͼ������˵����ȷ����

A. �����͵�����ʾ��Һ�У�c��CH3COO������c��CN����
B. �����͵�����ʾ��Һ�У�c��Na������c��OH������c��CH3COO������c��H����
C. �����͵�����ʾ��Һ�У�c��CH3COO������c��CN������c��HCN����c��CH3COOH��
D. �����͵�����ʾ��Һ�ж��У�c��CH3COO������c��OH������c��CH3COOH����c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Ũ�Ⱦ�Ϊ0.1mol/L����Һ����pH���±���ʾ���й�˵����ȷ���ǣ� ��
��� | �� | �� | �� | �� |
��Һ | NaCl | CH3COONH4 | NaF | CH3COONa |
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A.����ǿ����CH3COOH>HF
B.���ӵ���Ũ�ȣ���>��
C.����c(CH3COO-)=c(NH4+)=c(OH-)=c(H+)
D.�ں͢���c(CH3COO-)���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������д�������Ⱦ��SO2��NO����ҵ�ϱ�������Ϊ�������չ�ҵβ��SO2��NO���ɻ��Na2S2O3��NH4NO3��Ʒ������ͼ����(CeΪ��Ԫ��)��

����˵���������
A.Na2S2O4��SԪ�صĻ��ϼ�Ϊ+3
B.װ��������36 g ˮ����4 NA��H+(NA��������٤��������
C.װ�����ü���ȼ�ϵ�ؽ��е�⣬������24 g ����ʱ�������Ͽ�����10 mol Ce4+
D.װ������ôֲ�ƷNH4NO3��ʵ���������Ϊ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӵȡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com