
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O22SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)=C(金刚石,s) ![]() >0,则金刚石比石墨稳定
>0,则金刚石比石墨稳定
C.已知2C(s)+2O2(g)=2CO2(g) ![]() 1 2C(s)+O2(g)=2CO(g) △H2则△H1<△H2
1 2C(s)+O2(g)=2CO(g) △H2则△H1<△H2
D.已知H+(aq)+OH-(aq)=H2O(l) ![]() =-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ
=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后,溶液里各种离子物质的量浓度的关系是 ( )
A.c (OH-) = c(NH4+) + c (H+)B.c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C.c(NH4+) > c (Cl-)> c (OH-)> c (H+)D.c (Cl-)> c (H+) > c (NH4+) > c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法正确的是__________。
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度
(2)一定温度下,在密闭容器中充入1molN2和3molH2并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的![]() ,则N2的转化率为______________。
,则N2的转化率为______________。
(3)工业上合成氨的部分工艺流程如下:
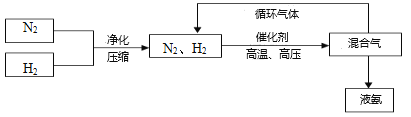
请用平衡移动原理来解释在流程中及时分离出氨气的原因_____________________________。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
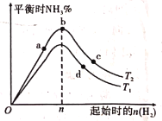
①图象中T2和T1的关系是:T2_______T1(填“>”“<”或“=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下该反应的化学平衡常数K=_______________。
(6)氨氧化法是工业生产中制取硝酸的主要途径。
已知:N2(g)+3H2(g) ![]() 2NH3(g) △H= -92 kJ·mol-1
2NH3(g) △H= -92 kJ·mol-1
N2(g)+O2(g) ![]() 2NO(g) △H= +181 kJ·mol-1
2NO(g) △H= +181 kJ·mol-1
2H2(g)+O2 (g)![]() 2H2O(g) △H= -484 kJ·mol-1
2H2O(g) △H= -484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细![]() 氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为
氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为![]() 含少量杂质
含少量杂质![]() 、FeO、
、FeO、![]() ,其制备实验流程如图1:
,其制备实验流程如图1:
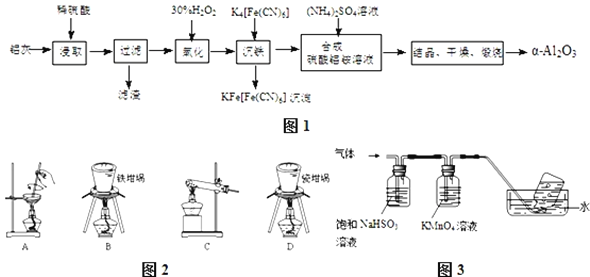
![]() 铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
![]() 用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______
用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______ ![]() 填选项编号
填选项编号![]() .
.
![]() 在实验流程中,加
在实验流程中,加![]() 的
的![]() 溶液发生的离子反应方程式为 ______ .
溶液发生的离子反应方程式为 ______ .
![]() 验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
![]() 若用调节pH溶液“沉铁”,则得到
若用调节pH溶液“沉铁”,则得到![]() ,已知:
,已知:![]() 时,
时,![]() ,则该温度下反应
,则该温度下反应![]() 的平衡常数为 ______ .
的平衡常数为 ______ .
![]() 煅烧硫酸铝铵晶体,发生的主要反应为:
煅烧硫酸铝铵晶体,发生的主要反应为:![]()
![]()
![]() ,将产生的气体通过图3所示的装置.
,将产生的气体通过图3所示的装置.
①集气瓶中收集到的气体是 ______ ![]() 填化学式
填化学式![]() .
.
②![]() 溶液褪色,发生的离子反应方程式为 ______ .
溶液褪色,发生的离子反应方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000mol·L-1和0.01000mol·L-1的标准盐酸。
②用0.1000mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00mL,结果用去盐酸19.60mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00mL,放入100mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00mL,用0.01000mol·L-1的盐酸滴定,用去盐酸34.80mL。请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?____;
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒
(2)滴定操作中,左手____,右手____,眼睛____;
(3)Ba(OH)2溶液的物质的量浓度是____;
(4)过滤所得浊液的目的是____;
(5)此空气样品中含CO2的体积分数为____;
(6)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果____(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:
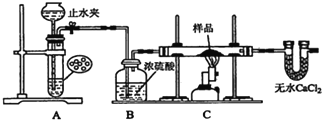
(1)仪器组装完成后,夹好止水夹,_____,则说明装置A的气密性良好.
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)
A.稀硫酸和锌片B.稀硝酸和铁片 C.氢氧化钠溶液和铝片D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号).
①打开止水夹②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________;丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;丁同学预设计实验证明另一种物质是否存在,其方案为__________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
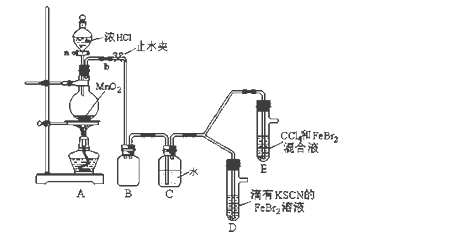
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硝技术是处理氮氧化物的有效方法之一。在1L的恒容密闭容器中充入2mol NH3、1mol NO和1mol NO2,发生反应:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
0 | 10 min | 20 min | 30 min | 40 min | |
T1K | 0 | 0.6 | 1.1 | 1.5 | 1.5 |
T2K | 0 | 0.8 | 1.4 | 1.4 | 1.4 |
回答下列问题:
(1)上述反应中___________(填字母)。
A. △S>0,△H>0 B. △S>0,△H<0 C. △S<0,△H>0 D. △S<0,△H<0
(2)T1_______(填“>”“<”或“=”)T2,理由是___________________________________________
(3)T1K下,0~20min内v(NO)=______________
(4)T2K下,NO2的平衡转化率为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com