
【题目】将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后,溶液里各种离子物质的量浓度的关系是 ( )
A.c (OH-) = c(NH4+) + c (H+)B.c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C.c(NH4+) > c (Cl-)> c (OH-)> c (H+)D.c (Cl-)> c (H+) > c (NH4+) > c (OH-)
【答案】C
【解析】
将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后,所得溶液中c(NH3H2O)=c(NH4Cl),此时NH3·H2O![]() NH
NH![]() + OH-,H2O
+ OH-,H2O![]() H++OH-。
H++OH-。
A. 依据电荷守恒c (OH-)+ c (Cl-) = c(NH4+) + c (H+),A错误;
B. 溶液中以NH3·H2O的电离为主,所以c(Cl-)<c(NH4+),c(H+)<c(OH-),B错误;
C. 因为NH3·H2O的电离是少量的,所以c(Cl-)>c(OH-),结合B选项的分析,可得出c(NH4+)>c(Cl-)>c(OH-)>c(H+),C正确;
D. c(H+)只来自水的微弱电离,所以 c(H+)<c(NH4+),D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O ②CH3COOH ③KHSO4。下列有关离子浓度分析一定不正确的是( )
A.向①中逐滴加入少量②,![]() 逐渐增大
逐渐增大
B.①、③等体积混合后溶液中存在:NH4+ +H2O![]() NH3·H2O+H+
NH3·H2O+H+
C.①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+ )
D.①、③按体积比2:1混合:c(NH4+)>c(NH3H2O)>c(SO42-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式中,正确的是
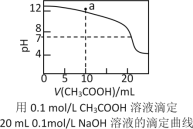
A.pH相同的①CH3COONa、②NaHCO3、③![]() 三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.如图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.如图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
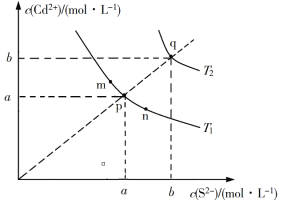
A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
B. 图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为![]() 。室温下,实验室里用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1MOH溶液,滴定曲线如图所示。下列说法正确的是
。室温下,实验室里用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1MOH溶液,滴定曲线如图所示。下列说法正确的是
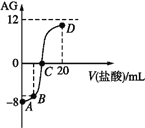
A. MOH为强碱
B. C点时加入盐酸的体积等于10mL
C. 若B点加入的盐酸体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-)
D. 滴定过程中从A点到D点溶液中水的电离程度:A<B<C<D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验内容、实验装置和对应的实验目的均正确的是
A. 测定中和热 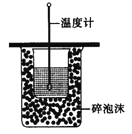
B. 比较Cu2+、Fe3+对反应速率的影响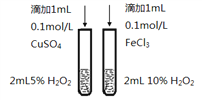
C. 比较醋酸和硼酸的酸性强弱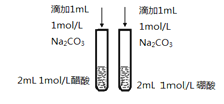
D. 比较温度对化学反应速率的影响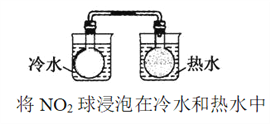
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O22SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)=C(金刚石,s) ![]() >0,则金刚石比石墨稳定
>0,则金刚石比石墨稳定
C.已知2C(s)+2O2(g)=2CO2(g) ![]() 1 2C(s)+O2(g)=2CO(g) △H2则△H1<△H2
1 2C(s)+O2(g)=2CO(g) △H2则△H1<△H2
D.已知H+(aq)+OH-(aq)=H2O(l) ![]() =-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ
=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com