
【题目】下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③![]() 三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
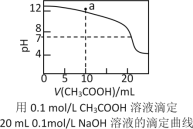
C.如图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.如图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
【答案】D
【解析】
A.从三种钠盐对应的酸的强弱来看,CH3COOH>H2CO3>C6H5OH,所以相同浓度的三种钠盐pH的大小是C6H5ON>NaHCO3>CH3COONa,所以pH相同的三份钠盐中c(Na+)浓度①>②>③,故A错误;
B.据从化学式NaHA可以看出,Na原子应与A原子的个数相等,即物料守恒,所以应该为c(Na+)=c (A2-)+c(HA-)+c(H2A) ,故B错误;
C.电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),pH=7时,溶液呈中性,此溶液中必有c(Na+)=c(CH3COO-),故C错误;
D.a点时加入NaOH的量为l0mL,所得溶液相当于CH3COONa和NaOH物质的量1﹕1混合所得的溶液。据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),据物料守恒有c(Na+)=2c(CH3COO-)+2c(CH3COOH),两式相减即得c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故D正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示,下列说法正确的是( )

A.化合物甲、乙均为手性分子
B.化合物甲中最多有8个原子共平面
C.化合物乙中采取sp3杂化的原子只有N、C
D.化合物甲的沸点明显高于化合物乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
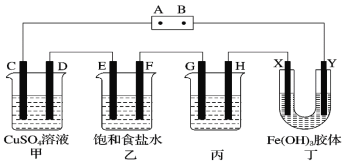
(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式为(电解质溶液是足量的):_______电解后若使电解质溶液复原需要加入适量的__________________
(3)如果收集乙装置中产生的气体,两种气体的体积比是(忽略气体的溶解)________。ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。若调控合适的电压可以利用乙装置制备ClO2,写出阳极产生ClO2的电极反应式__________ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂污水中含CN-,现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式)。
(5)装置丁中的现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 用广泛pH试纸测定1mol/L NaHSO3 溶液的酸碱性 | 测得pH=3.2 | NaHSO3 溶液呈酸性,证明HSO3-的电离大于水解 |
C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
D | 在0.1mol/LNa2S溶液中滴加少量等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液 | 先产生白色ZnS沉淀,后产生黑色CuS沉淀 | Ksp(ZnS)>Ksp(CuS) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。

已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1 mol·L-1HCl溶液滴定10.0 mL浓度为0.1 mol·L-1 Na2CO3溶液,所得滴定曲线如如图所示。下列说法正确的是
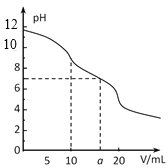
A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-)
B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)
D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以模拟铁的电化学防护。下列说法不正确的是 ( )
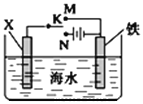
A.若X为碳棒,开关K置于N处,为外加电源的阴极保护法,可减缓铁的腐蚀
B.若X为碳棒,开关K置于N处,X极发生氧化反应
C.若X为锌棒,开关K置于M处,为牺牲阳极的阴极保护法,可减缓铁的腐蚀
D.若X为锌棒,开关K置于M处,铁极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后,溶液里各种离子物质的量浓度的关系是 ( )
A.c (OH-) = c(NH4+) + c (H+)B.c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C.c(NH4+) > c (Cl-)> c (OH-)> c (H+)D.c (Cl-)> c (H+) > c (NH4+) > c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com