
【题目】实验题
甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂: NaBr溶液、NaI溶液、新制的氯水
(1)实验目的:
①写出下列实验报告中的实验现象和离子方程式
实验步骤 | 实验现象 | 实验结论及离子方程式 |
| 甲___________ 乙___________ | 离子方程式 甲___________ 乙___________ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧。
W | X | Y |
Z |
请回答下列问题:
①写出Z的原子结构示意图:__________________。
②探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中用Z表示即可) _____
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI===Z↓+2I2+3H2O |
1 | ||
2 |
③由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:__________________。
【答案】 溶液由无色变为橙色 溶液由无色变为黄色 ![]()
![]() B 溴水
B 溴水 

![]() ··C··
··C··![]()
【解析】试题分析:(1)①氯气氧化性大于溴和碘,所以氯气能置换出溴和碘;②向溴化钠溶液中滴加氯水证明氧化性Cl2>Br2、向碘化钠溶液中滴加氯水证明氧化性Cl2>I2;③需要补充实验证明氧化性Br2>I2;(2)短周期元素X的最高正化合价是+5,说明X是ⅤA族元素,根据元素周期表,Y是ⅥA族元素,Y的单质可在空气中燃烧,所以Y是S元素,根据在元素周期表中的相对位置,W、X、Z分别是Si、P、Se。
解析:(1)①氯气氧化性大于溴和碘,所以氯气能置换出溴和碘,向溴化钠溶液中滴加氯水生成氯化钠和溴单质,现象是溶液由无色变为橙色,反应离子方程式是![]() ;向碘化钠溶液中滴加氯水生成氯化钠和碘单质,现象是溶液由无色变为黄色,反应离子方程式是
;向碘化钠溶液中滴加氯水生成氯化钠和碘单质,现象是溶液由无色变为黄色,反应离子方程式是![]() ;②向溴化钠溶液中滴加氯水证明氧化性Cl2>Br2、向碘化钠溶液中滴加氯水证明氧化性Cl2>I2;不能证明氧化性Br2>I2,故甲同学设计的实验方案部分合理,选B;要证明氧化性Br2>I2,需要向NaI溶液中滴加溴水,若溶液变为黄色,则证明氧化性Br2>I2,所以完成实验还需要的试剂是溴水;(2)根据以上分析,Y是S元素, W、X、Z分别是Si、P、Se。①Se的原子结构示意图:
;②向溴化钠溶液中滴加氯水证明氧化性Cl2>Br2、向碘化钠溶液中滴加氯水证明氧化性Cl2>I2;不能证明氧化性Br2>I2,故甲同学设计的实验方案部分合理,选B;要证明氧化性Br2>I2,需要向NaI溶液中滴加溴水,若溶液变为黄色,则证明氧化性Br2>I2,所以完成实验还需要的试剂是溴水;(2)根据以上分析,Y是S元素, W、X、Z分别是Si、P、Se。①Se的原子结构示意图: 。
。
②Z是ⅥA族元素,最高价是+6价,H2ZO3中Z元素的化合价是+4,所以H2ZO3既有氧化性又有还原性、酸性,相应的化学方程式是
③化合物COS中,所有原子的最外层都满足8电子结构,与二氧化碳为等电子体,等电子体微粒的结构相似,COS的电子式是![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列化学方程式不能用离子方程式Ba2++SO42-=BaSO4↓表示的是 ( )
A. Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 B. BaCl2+Na2SO4=BaSO4↓+2NaCl
C. BaCl2+H2SO4=BaSO4↓+2HCl D. BaCO3+H2SO4=BaSO4↓+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是
A. 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同的电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)X的电子式为___________。
(2)B单质的结构式为___________;用电子式表示E的气态氢化物的形成过程:___________________________。
(3)C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,该物质属于________(填“离子化合物”或“共价化合物”)。
(4)B、C、E分别与A形成的化合物中最稳定的是______(写结构式)。
(5)D是同周期简单阳离子中离子半径最____的元素。
(6)F的单质在反应中常作________剂(填“氧化”或“还原”)。F的单质与水反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示装置的叙述不正确的是( ) 
A.这是一个原电池装置
B.该装置中Pt为正极,电极反应为:O2+2H2O+4e﹣═4OH﹣
C.该装置中Fe为负极,电极反应为:Fe﹣2e﹣+2OH﹣═Fe(OH)2
D.这是电解NaOH溶液的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
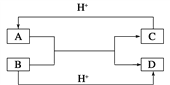
(1)如果A、B、C、D均是10电子的粒子,请写出A、D的电子式:A_________;D_______。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:A与B在溶液中反应的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为( )
A. a g·mol-1B. a gC. 50a g·mol-1D. 50a g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,下列关这四种元素及其化合物的说法中正确的是

A. X、Y、Z、W可能均为金属元素
B. 气态氢化物的稳定性Z>W>X>Y
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com