
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜。请回答下列问题。
(1)Fe2+的电子排布式是____________________________。
(2)液态SO2可发生自偶电离![]() ,SO2属于_____________(选填“极性分子”或“非极性分子”),
,SO2属于_____________(选填“极性分子”或“非极性分子”),![]() 的空间构型是___________________。
的空间构型是___________________。
(3)范德华力可分为色散力、诱导力和取向力三类,其中取向力只存在于极性分子和极性分子之间,则H2S的水溶液中存在的取向力有_______种。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____________。乙硫醇的沸点比乙醇的沸点低,原因是___________。
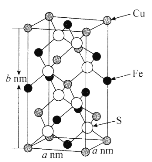
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是______________,其密度为_____________g/cm3(阿伏加德罗常数的值用NA表示)。
【答案】![]() (或
(或![]() ) 极性分子 三角锥形 3
) 极性分子 三角锥形 3 ![]() 乙醇分子间可形成氢键而乙硫醇分子间不能
乙醇分子间可形成氢键而乙硫醇分子间不能 ![]()
![]()
【解析】
(1)Fe的原子序数为26,失去2个电子形成![]() ;
;
(2)![]() 的价层电子对数为3,孤对电子数为1,则空间构型是V形,;
的价层电子对数为3,孤对电子数为1,则空间构型是V形,;![]() 的价层电子对数为4,孤对电子数为1,空间构型为三角锥形;
的价层电子对数为4,孤对电子数为1,空间构型为三角锥形;
(3)![]() 的水溶液中有
的水溶液中有![]() 和
和![]() 两种极性分子,
两种极性分子,![]() 分子间能形成氢键;
分子间能形成氢键;
(4)乙硫醇中硫原子与氢原子和碳原子形成两个键,价层电子对数为4,有2对孤电子对;
(5)由均摊法计算可得。
(1)Fe的原子序数为26,失去2个电子形成![]() ,则
,则![]() 的核外有24个电子,电子排布式是
的核外有24个电子,电子排布式是![]() ,简化形式是
,简化形式是![]() ,故答案为:
,故答案为:![]() (或
(或![]() );
);
(2)![]() 的价层电子对数为3,孤对电子数为1,则空间构型是V形,分子中正电中心和负电中心不重合,属于极性分子;
的价层电子对数为3,孤对电子数为1,则空间构型是V形,分子中正电中心和负电中心不重合,属于极性分子;![]() 的价层电子对数为4,孤对电子数为1,空间构型为三角锥形,故答案为:极性分子;三角锥形
的价层电子对数为4,孤对电子数为1,空间构型为三角锥形,故答案为:极性分子;三角锥形
(3)![]() 的水溶液中有
的水溶液中有![]() 和
和![]() 两种极性分子,
两种极性分子,![]() 分子间能形成氢键,因此溶液中存在三种取向力:
分子间能形成氢键,因此溶液中存在三种取向力:![]() 和
和![]() 、
、![]() 和
和![]() 、
、![]() 和
和![]() ,故答案为:3;
,故答案为:3;
(4)乙硫醇中硫原子与氢原子和碳原子形成两个键,价层电子对数为4,有2对孤电子对,则S原子采用![]() 杂化,故答案为:
杂化,故答案为:![]() ;
;
(5)由晶胞可知,铜原子位于顶点、面上和体心,原子个数为![]() =4,铁原子位于位于棱上、面上,原子个数为
=4,铁原子位于位于棱上、面上,原子个数为![]() =4;8个硫原子位于体内,因此X的化学式是
=4;8个硫原子位于体内,因此X的化学式是![]() ,X晶胞体积为
,X晶胞体积为![]() ,每个晶胞的质量为
,每个晶胞的质量为![]() ,因此密度为
,因此密度为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4溶液与H2C2O4(草酸)溶液反应研究影响反应速率的因素,一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图所示:
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |

(1)写出该反应的离子方程式__________________________________________。
(2)该实验探究的是________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是______>______(填实验序号)。
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=______ mol·L-1(假设混合溶液的体积为50mL)。
(4)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定_________________________来比较化学反应速率。
(5)小组同学发现反应速率变化如图,其中t1-t2时间内速率变快的主要原因可能是:①反应放热,②___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是水下大型机械常用电源,其工作原理如图所示。电池工作时,下列说法错误的是( )
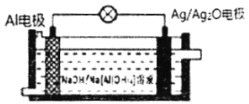
A.Al是电池的负极B.电池负极附近溶液pH升高
C.Al极反应式为: Al-3e- +4OH -==[AI(OH)4]-D.Ag/Ag2O 电极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:![]() > H2CO3>
> H2CO3>![]() >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 转变为
转变为 的最佳方法是
的最佳方法是
A. 与稀H2SO4共热后,加入足量的NaOH溶液
B. 与稀H2SO4共热后,加入足量的NaHCO3溶液
C. 与足量的NaOH溶液共热后,再通入足量CO2
D. 与足量的NaOH溶液共热后,再加入适量H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格:
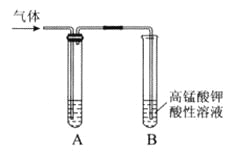
序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | _________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是________________。 | NaOH溶液 |
③ | 乙炔 | 电石与饱和食盐水反应 | _________ |
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
试管编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是_____________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖)![]() 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烯醛是一种重要的有机合成中间体,沸点为177℃,密度为0.848 g·cm-3,不溶于水。实验室采用正丁醛制各少量辛烯醛,反应原理为:
CH3CH2CH2CHO![]()

![]()
![]()
实验步骤如下:
步骤Ⅰ:向三颈烧瓶中加入6.3 mL 2% NaOH溶液,在充分搅拌下,从恒压滴液漏斗慢慢滴入5mL正丁醛。
步骤Ⅱ:充分反应后,将反应液倒入如图仪器中,分去碱液,将有机相用蒸馏水洗至中性。

步骤Ⅲ:经洗涤的有机相加入适量无水硫酸钠固体,放置一段时间后过滤。
步骤Ⅳ:减压蒸馏有机相,收集60~70℃/1.33~4.00kPa的馏分。
(l)步骤Ⅰ中的反应需在80℃条件下进行,适宜的加热方式为___ 。使用冷凝管的目的是 _______。
(2)步骤Ⅱ中所用仪器的名称为_____ 。碱液在仪器中处于_____(填“上层”或“下层”),如何判断有机相已经洗至中性:______。
(3)步骤Ⅲ中加入无水硫酸钠固体的作用是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com