
【题目】Al3+与AlO2-不能大量共存是它们相互促进水解完全造成的么?__________
【答案】是
【解析】
Al3+水解消耗OH-,AlO2-水解消耗H+,结合溶液的酸碱性及离子浓度变化分析。
Al3+是强酸盐电离产生,Al3+会发生水解反应,消耗水电离产生的OH-,水解方程式为:Al3++3H2O![]() Al(OH)3+3H+,水解产生H+,使溶液显酸性;
Al(OH)3+3H+,水解产生H+,使溶液显酸性;
AlO2-是强碱盐电离产生,AlO2-会发生水解反应,消耗水电离产生的H+,水解方程式为:AlO2-+2H2O![]() Al(OH)3+OH-,水解产生OH-,使溶液显碱性;两种离子在同一溶液中,水解产生的H+、OH-发生中和反应,使二者水解程度增大,最终都有转化为Al(OH)3沉淀,反应方程式为:Al3++3AlO2-+6H2O =4Al(OH)3↓,因此二者不能大量共存。
Al(OH)3+OH-,水解产生OH-,使溶液显碱性;两种离子在同一溶液中,水解产生的H+、OH-发生中和反应,使二者水解程度增大,最终都有转化为Al(OH)3沉淀,反应方程式为:Al3++3AlO2-+6H2O =4Al(OH)3↓,因此二者不能大量共存。


科目:高中化学 来源: 题型:
【题目】下列各种烃与氢气完全加成后,能生成2,3,3—三甲基戊烷的是 ( )
A.
B.
C.CH2=CHC(CH3)2CH(CH3)2
D.(CH3)3CC(CH3)=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

填写下列空白:
(1) 甲中不含氧原子的官能团名称是__________;下列试剂能与甲反应而褪色的是__________ (填标号)。
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2) 甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式____________
(3) 淀粉通过下列转化可以得到乙(C2H6O2)(其中AD均为有机物,A为一种单糖,B为一种有特殊香味的一元醇,C为一种气体)
![]()
B转化到乙的一系列反应中涉及到的反应类型有__________。
a.消去反应 b.取代反应
c.加成反应 d.加聚反应
B转化为C的化学反应方程式为______________________________
(4) 化合物丁仅含碳、氢、氧三种元素,其相对分子质量为110。丁与FeCl3溶液作用显现紫色,且丁分子中苯基上的一氯取代物只有一种。则丁的结构简式为______________
(5) 已知:![]()
![]()
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于恒容的密闭真空容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15 | 20 | 25 | 30 | 35 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/ 10-3mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法正确的是
A. 该反应在低温下可以自发进行
B. 当体系中气体的平均相对分子质量不变时,说明该反应达到了平衡状态
C. 恒温条件下,向容器中再充入2mol NH3和1molCO2,平衡向左移动,平衡后,NH3的浓度减小
D. 15℃时,该反应的平衡常数约为2.05×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ. 某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液+1 mL H2O | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+1 mL HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+1 mL NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是__________(写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图1所示。分析该图能够得出的实验结论是____。
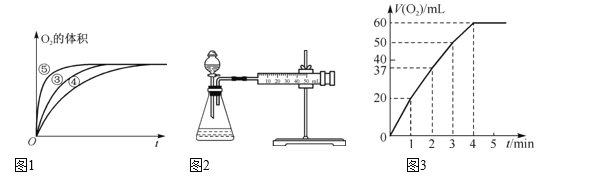
Ⅱ. MnO2对H2O2的分解有催化作用,某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将状态不同的0.1 g MnO2分别加入盛有50 mL等浓度的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2状态 | 触摸试管情况 | 观察结果 | 反应完成所需时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 4 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:__,该反应是____反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)实验过程中放出气体的体积(标准状况)和时间的关系如图3所示。解释反应速率变化的原因:__,计算H2O2的初始物质的量浓度为____。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化合物的结构简式:
(1)2甲基4乙基庚烷___________________________;
(2)2甲基1,3丁二烯___________________________;
(3)3,4二甲基2戊醇___________________________;
(4)2,4,6三硝基甲苯___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氮化硫(SN)x和K3C60是两种不同类型的超导材料。回答下列问题:
(1)在基态K原子中,能量最低的空轨道的符号是_____________。
(2)S、N、K三种元素的第一电离能由大到小的顺序是____________。
(3)(SN)x具有类似黄铜的金属光泽和导电性,其结构如下图:
![]()
以S2Cl2为原料可制取(SN)x:S2Cl2→…S4N4 ![]() S2N2
S2N2 ![]() (SN)x
(SN)x
①(SN)x中N原子的杂化方式是_________;(SN)x的晶体类型是______;
②S2Cl2的结构式为________;
③Ag元素位于周期表第5周期、IB族,基态Ag原子的价电子排布式为__________。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。
①在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为___________。
②C60与金刚石互为同素异形休,比较两者的熔沸点并说明理由____________。
③C60的结构是一种多面体,如图。多面体的顶点数、面数和棱边数的关系遵循欧拉定律:顶点数+面数-棱边数=2。C60分子中所含的五边形和六边形的个数分别为_____、______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com