
| A、Y的气态简单氢化物的热稳定性比W的强 |
| B、X的最高价氧化物对应水化物的酸性比W的弱 |
| C、Y分别与Z、W形成的化合物均为碱性氧化物 |
| D、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、2346 kJ |
| B、2670 kJ |
| C、1698kJ |
| D、2063 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
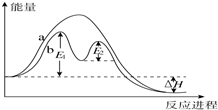
| A、反应过程a有催化剂参与 |
| B、该反应为放热反应,热效应不等于△H |
| C、使用催化剂,可改变该反应的活化能 |
| D、有催化剂条件下,反应的活化能等于E1-E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
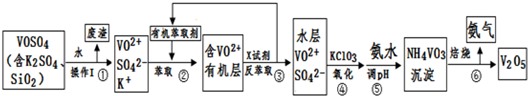
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
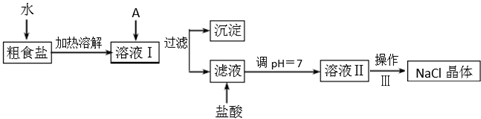
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L |
| B、2mol/L |
| C、5mol/L |
| D、3.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的醋酸溶液中:c(CH3COOH)>c(H+)>c(CH3COO-) |
| B、0.1mol/L的明矾[KAl(SO4)2?12H2O]溶液中:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
| C、等浓度的Na2CO3与NaHCO3混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-) |
| D、稀硫酸中滴入氨水至中性后所得的溶液中:c(NH4+)=c(SO42-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往明矾溶液中逐滴加入氢氧化钡溶液至SO42-恰好完全沉淀Al3++2 SO42-+2 Ba2++4 OH-=2 BaSO4↓+AlO2-+2 H2O |
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C、用稀HNO3溶液溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
| D、AgNO3溶液中加入过量的氨水:Ag++NH3?H2O=AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
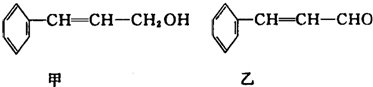
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4退色能在稀硫酸中水解 |
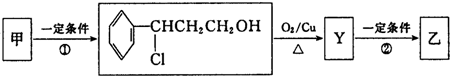
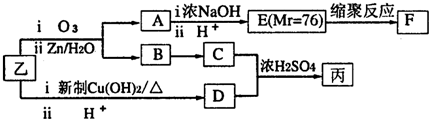
| iO3 |
| iiZn/H2O |
| ||
| ii H+ |
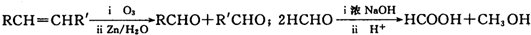
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com