
����Ŀ��ʵ�������ܶ�Ϊ1.25g/mL��������Ϊ36.5%��Ũ��������480 mL0.1mol/L�����ᡣ��ش��������⣺
��1��Ũ��������ʵ���Ũ��Ϊ _________��
��2������480 mL0.1 molL��1��������Ҫ�������У��ձ�������������ͷ�ιܡ�_____��_______��
��3������Ͳ��ȡŨ���� ___mL
��4��ʹ������ƿ������Һʱ�����������ʹ������ҺŨ��ƫ�͵���___��
����������ƽ��ʹ�����룩����ʱ�����������������λ�÷ŵߵ���
����Щ�����ܽ����ȣ���δ����ȴ��ת��������ƿ��
����Һת�Ƶ�����ƿ���ձ���������δ������ˮϴ�ӡ�
��ת����Һʱ��������������ƿ�ڽӴ�
�����ݺ�ҡ�ȣ�����Һ�潵�ͣ��ֲ�������ˮ�����´ﵽ�̶���
���𰸡�12.5mol��L��1 500mL����ƿ 10mL��Ͳ 4.0 �٢ۢܢ�
��������
��1���ܶ�Ϊ1.25gmL1,��������Ϊ36.5%����������ʵ���Ũ��Ϊ��![]() mol/L=12.5mol/L��
mol/L=12.5mol/L��
����12.5mol/L��
��2������һ�����ʵ���Ũ�ȵ���Һ���裺���㡢�������ܽ⡢ת�ơ�ϴ�ӡ����ݡ�ҡ�ȵȣ��õ���������������ƽ��ҩ�ס��ձ�������������Ͳ��500mL����ƿ�����Ի�ȱ�ٵ�������500mL����ƿ��10mL��Ͳ��
�ʴ�Ϊ��500mL����ƿ��10mL��Ͳ��
��3������480mL0.1molL1������Ӧѡ��500mL��Һ,����ҪŨ�������ΪV����������Һϡ���ɣ�0.5L��0.1molL1=12.5mol/L��V�����V=4.0mL��
����4.0��
��4������������ƽ��ʹ�����룩����ʱ�����������������λ�÷ŵߵ��ˣ������������������٣���ҺŨ��ƫ�ͣ��������⣬������ȷ��
����Щ�����ܽ����ȣ���δ����ȴ��ת��������ƿ������Һ��ȴʱ����Һ������٣�����������Һ��Ũ��ƫ���������⣬��������
����Һת�Ƶ�����ƿ���ձ���������δ������ˮϴ�ӣ�������������û��ת��������ƿ�������������٣�����������Һ��Ũ��ƫС���������⣬������ȷ��
��ת����Һʱ��������������ƿ�ڽӴ�����ʹ����˳ƿ����������ƿ�������������٣�����������Һ��Ũ��ƫС���������⣬������ȷ��
�����ݺ�ҡ�ȣ�����Һ�潵�ͣ��ֲ�������ˮ�����´ﵽ�̶��ߣ���������ƿ����Һ���ƫ����ҺŨ��ƫС���������⣬������ȷ��
��Ϊ���٢ۢܢ���


 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������PAA��![]() �����и���ˮ�ԣ���״PAA�ڿ�ѹ�ԡ���ˮ�Եȷ�����������PAA����״PAA���Ʊ������ǣ�����ϩ����NaOH�кͣ���������������a���������ۺϡ��䲿�ֽṹƬ����ͼ������˵������ȷ����
�����и���ˮ�ԣ���״PAA�ڿ�ѹ�ԡ���ˮ�Եȷ�����������PAA����״PAA���Ʊ������ǣ�����ϩ����NaOH�кͣ���������������a���������ۺϡ��䲿�ֽṹƬ����ͼ������˵������ȷ����
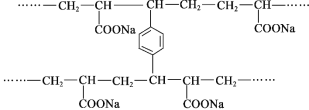
A. ����PAA�ĵ��岻����˳���칹����
B. �γ���״�ṹ�Ĺ��̷����˼Ӿ۷�Ӧ
C. ������a�Ľṹ��ʽ��![]()
D. PAA�ĸ���ˮ���롪COONa�й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ��Ӱ��������������ܵ�ҩ���ͨ�����·����ϳɣ�
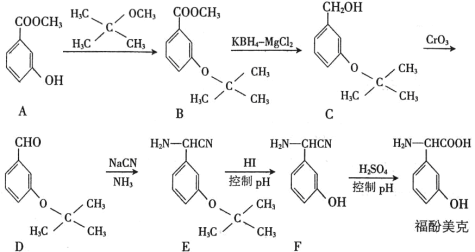
��Ҫ��ش��������⣺
��1������A��������_________________��
��2��B��C��ת������_____________���Ӧ���ͣ���Ӧ��
��3���������������A��B�����Ŀ����________________________________________��
��4��A����������������Һ��Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��5��A�ķ�����ͬ���칹��X��������������
I.����NaHCO3��Ӧ�ų����壻 II.����FeCl3��Һ������ɫ��Ӧ��
��������������ͬ���칹����_______�֣����к˴Ź���������5�����շ�Ľṹ��ʽΪ_______��
��6�����������ϳ�·�ߺ���Ϣ������ȩΪԭ�ϣ����Լ���ѡ��������Ʊ�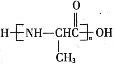 �ĺϳ�·�ߣ�__________��
�ĺϳ�·�ߣ�__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Cl2ͨ������KOH��Һ�������п�����KCl��KClO��KClO3���� ��ֵ���¶ȸߵ��йء���n (KOH)=a molʱ�������й�˵���������
��ֵ���¶ȸߵ��йء���n (KOH)=a molʱ�������й�˵���������
A.��ij�¶��£���Ӧ�� =11������Һ��
=11������Һ�� =
=![]()
B.�μӷ�Ӧ�����������ʵ�������![]() a mol
a mol
C.�ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���n�ķ�Χ��![]() a mol �� n(e -)��
a mol �� n(e -)��![]() a mol
a mol
D.�ı��¶ȣ�������KClO3��������۲���Ϊ ![]() a mol
a mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����������͵����������ܱ������н��з�Ӧ��H2(g)��I2(g)![]() 2HI(g)(����Ӧ����)����Ӧ����5���Ӳ�õ⻯���Ũ��Ϊ0.5mol/L����������Ũ��Ϊ0.25mol/L������д���¿հף�
2HI(g)(����Ӧ����)����Ӧ����5���Ӳ�õ⻯���Ũ��Ϊ0.5mol/L����������Ũ��Ϊ0.25mol/L������д���¿հף�
��1��v(HI)=__��v(H2)=__��H2����ʼŨ��=__��
��2����������Ӧ�ﵽƽ��ʱ����ƽ��Ũ��c(HI)��c(I2)��c(H2)�Ĺ�ϵ��__(�������������2��1��1��������Ϊ������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ��25����95��ʱ�������ƽ��������ͼ��ʾ��

��1����25��ʱˮ�ĵ���ƽ������ӦΪ________������A������B��������˵������________��
��2��95��ʱ����pH=9��NaOH��Һ��pH=4��H2SO4��Һ��ϣ������û����Һ��pH=7����NaOH��Һ��pH=4��H2SO4��Һ�������Ϊ________��
��3��95��ʱ����100���pH1=a��ijǿ����Һ��1���pH2=b��ijǿ����Һ��Ϻ���Һ�����ԣ�����ǰ����ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2molSO2��1molO2����һ���ݻ����ܱ������У��ڴ��������½������з�Ӧ��2SO2(g)+O2(g)![]() 2SO3(g) ��H=-197kJ/mol�����ﵽƽ��״̬ʱ������˵������ȷ���ǣ� ��
2SO3(g) ��H=-197kJ/mol�����ﵽƽ��״̬ʱ������˵������ȷ���ǣ� ��
A.�ﵽ��Ӧ��ʱ������SO3Ϊ2mol
B.�ﵽ��Ӧ��ʱ��Ӧ�ų�������С��197kJ
C.�ﵽ��Ӧ��ʱSO2��O2��SO3�ķ�����֮��һ��Ϊ2��1��2
D.�ﵽ��Ӧ��ʱO2���������ʵ���SO3����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�����pH=2�������pH=2�Ĵ�����Һ�ң���������в����ش����⣺
��1��������0.lmol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ���������__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)��c(OH-) D.c(OH-)/c(H+)
��2��ȡ10mL����Һ����������ˮ������ĵ���ƽ��___________(����������������������������)�ƶ�����ȡ10mL������Һ������������ˮ�����ƹ��� (����������ǰ����Һ������ֲ���)���������ܽ������Һ��c(H+)/c(CH3COOH)�ı�ֵ��___________(������������ ��С��������ȷ����)��
��3��ȡ������ļס�������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һ�к��������ĵ�NaOH��Һ�������С��ϵΪ��V(��)___________V(��) (����>������ <������=��)��
��4����֪25��ʱ��������ĵ���ƽ�ⳣ��������
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ��K1 | 1.8��l1-5 | 4.3��l0-7 | 3.0��10-8 |
K2 | - - | 5.6��10-11 | - - |
�����������ӽ��H+������ǿ����___________��
A.HCO3- B.CO32- C.ClO- D.CH3COO-
��5����������ȡ����Һϡ��100������pH=___________��ȡ99mL����Һ��lrnLlmol/L��NaOH��Һ���(������Һ����仯)���ָ�������ʱ��pH=______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL0.05mol��L��1��ijϡ��H2B��Һ�е���0.1mol��L��1��ˮ����Һ����ˮ�����������Ũ������백ˮ����仯��ͼ�����з�����ȷ���ǣ� ��

A. NaHB��Һ����Ϊ���ԣ�Ҳ����Ϊ����
B. A��B��C������Һ��pH����С��D��E��F������Һ��pH��������
C. E��Һ������Ũ�ȴ�С��ϵ��c(NH4+)>c(B2��)>c(OH��)>c(H+)
D. F����Һc(NH4+)=2c(B2��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com