
| A、1molN2所含分子数约为6.02×1023 |
| B、58.5g NaCl所含离子数约为6.02×1023 |
| C、标准状况下,22.4L H2所含原子数约为6.02×1023 |
| D、常温常压下,分子总数约为6.02×1023的SO2的质量是64 |
| m |
| M |
| N |
| NA |
| 22.4L |
| 22.4L/mol |
| 6.02×1023 |
| 6.02×1023 |


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、盐酸和氢氧化钠溶液之间的中和反应 | ||||
B、CO2+C
| ||||
C、金属镁燃烧:2Mg+O2
| ||||
| D、生石灰溶于水:CaO+H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、6:3:2 |
| C、3:2:1 |
| D、9:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCl2参加的任何反应转移电子数都是2NA |
| B、1mol/L的NaCl溶液中含有NA个Na+ |
| C、标准状况下,22.4ml水中含有的分子数约为1.24NA |
| D、1molFeCl3完全水解生成NA个胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78gNa2O2固体中含有的阴离子数为NA |
| B、标准状况下,2.24L氖气所含原子数为0.2NA |
| C、1molCl2与足量Fe反应,转移的电子数为3NA |
| D、标准状况下,2.24L已烷含有碳原子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2 L氧气所含的原子数为 NA |
| B、1.8 g 的NH4+离子中含有的电子数为 10NA |
| C、常温常压下,48 g O3含有的氧原子数为 3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为 0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
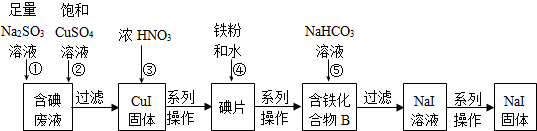
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com