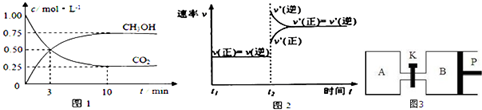
分析:(1)①由图2可知,正、逆反应速率都增大,为升高温度,且逆反应速率增大更多,反应向逆反应进行,据此判断;
②由图可知,前3min时二氧化碳的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,根据v=
算v(CO
2),再利用速率之比等于化学计量数之比计算v(H
2);
③利用三段式计算出反应混合物各组分的平衡时的浓度,计算的平衡浓度,转化率,根据体积分数的定义计算CH
3OH的体积分数;
(2)恒温、恒压条件下,气体的体积之比等于其物质的量之比,根据气体的体积计算参加反应的甲醇的物质的量,再根据转化率公式计算转化率;
打开K,AB组成的是恒温恒压容器,依据压强变化和物质的量变化成正比计算得到;
(3)一定条件下的密闭容器中,反应3H
2(g)+3CO(g)?CH
3OCH
3(g)+CO
2(g)△H<0,达到平衡时,要提高CO的转化率,可以采取的措施是使平衡正向进行,结合化学平衡移动原理分析选项;
(4)设平衡时转化的浓度为x,则
2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)
起始:x O 0
转化:1.2 0.6 0.6
某时刻:0.9 0.6 0.6
结合平衡常数概念和浓度积常数比较分析计算得到,以此解答该题.
解答:
解:(1)①由图2可知,正、逆反应速率都增大,为升高温度,且逆反应速率增大更多,反应向逆反应进行,故正反应为放热反应,故答案为:放热;
②由图可知,10min到达平衡时二氧化碳的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,所以v(CO
2)=
=
mol/(L?min),速率之比等于化学计量数之比,所以v(H
2)=3v(CO
2)=3×
mol/(L?min)=0.5mol/(L?min),
故答案为:0.5mol/(L?min);
③平衡时二氧化碳的浓度为0.25mol/L,则:
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
由计算可知,平衡时CH
3OH的体积分数ω=
×100%=30%,
故答案为:30%;
(2)B中是等压条件下的反应,等压条件下,气体的物质的量之比等于其体积之比,反应前气体的物质的量是3.6mol,则反应后气体的物质的量=
×3.6mol=5.04mol,根据CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)知,参加反应的n(CH
3OH)=
=0.72mol,则甲醇的转化率=
×100%=60%;
打开K时,AB组成一个等温等压容器,相应的起始投入总物质的量与平衡的总体积成正比,设打开K重新达到平衡后总的体积为x,则x:(3.6+4.5)=1.4a:4.5,
求得x=2.52a,所以B的体积为2.52a-a=1.52a,
故答案为:60%;1.52a;
(3)一定条件下的密闭容器中,反应3H
2(g)+3CO(g)?CH
3OCH
3(g)+CO
2(g)△H<0
达到平衡时,要提高CO的转化率,可以采取的措施是
A.反应是放热反应,升温平衡逆向进行,CO的转化率减小,故A错误;
B.反应是气体体积减小的反应,加压平衡正向减小,一氧化碳转化率增大,故B正确;
C.增加CO的浓度,一氧化碳转化率减小,故C错误;
D.分离出二甲醚(CH
3OCH
3),平衡正向进行,一氧化碳转化率增大,故D正确;
E.加入催化剂改变反应速率,不改变化学平衡,一氧化碳转化率不变,故E错误;
故答案为:BD;
(4)设甲醇起始浓度为x,则
2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)
起始:x O 0
转化:1.2 0.6 0.6
某时刻 0.9 0.6 0.6
A.CH
3OH的起始浓度为x=1.2mol/l+0.9mol/L=2.1mol/L,故A正确;
B.浓度商Q=
=0.44<100,反应未达到平衡,反应正向进行:平衡时CH
3OH的浓度小于0.9mol/L,故B错误;
C.浓度商Q=
=0.44<100,反应未达到平衡,反应正向进行,此时正反应速率大于逆反应速率,故C正确;
D.设平衡时生成甲醚的浓度为x,则
2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)
起始:2.1 O 0
转化:2x x x
平衡 2.1-2x x x
K=
=100
x=1mol/L
平衡时CH
3OH的转化率=
×100%=95.2%,大于80%,故D错误;
故答案为:AC;



 一线名师权威作业本系列答案
一线名师权威作业本系列答案
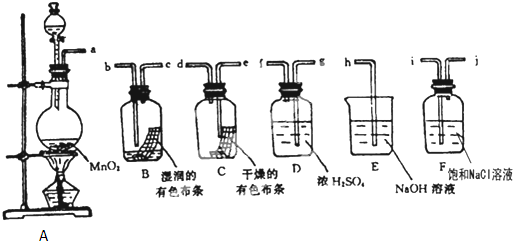
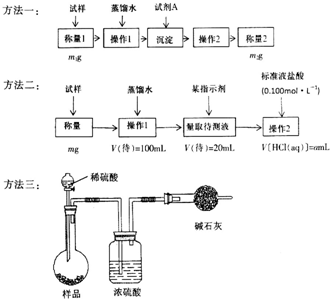 欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.