
| 试剂Z | 离子X | 离子Y | |
| A | NH3.H2O | Al3+ | Mg2+ |
| B | AgNO3 | Cl- | CO32- |
| C | Na2SO4 | Ba2+ | Mg2+ |
| D | Ba(NO3)2 | SO42- | CO32- |
| A、A | B、B | C、C | D、D |


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
| A、根据同周期元素的电负性变化趋势,推出Cl的电负性比S大 |
| B、根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
| D、根据强酸可以制取弱酸的规律,推出将HCl加入到AgNO3溶液中能制备HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热加压 |
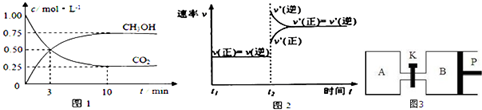
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol L -1 | 0.9 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 灼烧 |
| 浸泡 |
| ① |
| ② |
| 适量Cl2 |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
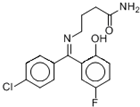
| A、该分子在1H核磁共振谱中有12个峰 |
| B、久置在空气中的普罗加比会因氧化而变质 |
| C、1 mol普罗加比最多可与3 mol NaOH反应 |
| D、一定条件下,1mol普罗加比最多能与2mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com