
【题目】将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是( )
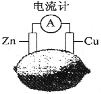
A.将电能转换为化学能
B.电子由铜片流出经导线到锌
C.一段时间后,锌片质量减轻
D.铜片一侧柠檬变蓝色,产生Cu2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】莳萝脑是一种抗肝病药剂,其合成路线如下:

(1)写出化合物B中含氧官能团的名称:_____和_____。
(2)试剂X是一溴代烃,其结构简式为_____;在上述七步反应中,属于消去反应的是_____(填序号)。
(3)写出反应⑤的化学方程式:___________。
(4)C的一种同分异构体满足下列条件:
Ⅰ.有5种化学环境不同的氢原子且苯环上的一溴代物只有两种;
Ⅱ.既能发生银镜反应又能与NaHCO3溶液反应放出CO2。
写出该同分异构体的一种结构简式:_______。
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr2+不稳定,极易被氧气氧化,不与锌反应。醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、CrCl3溶液、CH3COONa溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如下图所示。制备过程中发生的相关反应如下所示:
Zn+2HCl===ZnCl2+H2↑
Zn+2CrCl3===2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O===[Cr(CH3COO)2]2·2H2O(晶体)
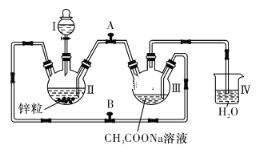
试回答下列问题:
(1)本实验中配制溶液所用的蒸馏水需事先煮沸,原因是__________。
(2)往仪器Ⅱ中加盐酸和CrCl3溶液的顺序最好是__________________________,理由是____________。
(3)为使生成的CrCl2溶液与CH3COONa溶液混合,应关闭阀门____(填“A”或“B”,下同),打开阀门_____。
(4)本实验中锌粒要过量,其原因除了使锌与CrCl3充分反应得到CrCl2外,另一个作用是________。仪器Ⅳ的主要作用是___________。
(5)已知实验时取用的CrCl3溶液中含溶质9.51 g,取用的CH3COONa溶液为1.5 L 0.1 mol/L,其他反应物足量。实验后得干燥的[Cr(CH3COO)2]2·2H2O 9.4 g,则该实验所得产品的产率为________(用百分数表示,保留3位有效数字)(不考虑溶解的醋酸亚铬水合物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约为21%)的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍的工艺流程如下:
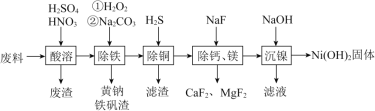
回答下列问题:
⑴合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应生成的气体只有N2。写出金属镍溶解的离子方程式:_______。
⑵“除铁”时H2O2的作用是__________,为了证明添加的H2O2已足量,应选择的试剂是__________(填“铁氰化钾”或“硫氰化钾”)溶液。
⑶“除铜”时,反应的离子方程式为__________,若用Na2S代替H2S除铜,优点是__________。
⑷已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是__________。
⑸镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M + Ni(OH)2![]() MH + NiOOH(式中M为储氢合金),写出电池放电过程中正极的电极反应式:__________。
MH + NiOOH(式中M为储氢合金),写出电池放电过程中正极的电极反应式:__________。
⑹已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组为测定黄钠铁矾的组成,进行了如下实验:
步骤Ⅰ.称取4.850g黄钠铁矾样品,加盐酸完全溶解后,配成100.00mL溶液A;
步骤Ⅱ.量取25.00mL溶液A,加入足量的KI,用0.2500 mol·L-1的Na2S2O3溶液进行滴定(反应为I2 + 2Na2S2O3 = 2NaI + Na2S4O6 ),滴定至终点时消耗30.00mL Na2S2O3溶液。
步骤Ⅲ![]() 另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
①用Na2S2O3溶液进行滴定时,使用的指示剂为__________,滴定达到终点时的颜色变化为__________。
②黄钠铁矾的化学式为 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用图装置可以探究![]() 与
与![]() 反应生成
反应生成![]() 沉淀的条件。下列判断正确的是( )
沉淀的条件。下列判断正确的是( )
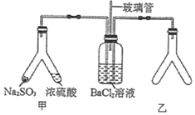
A.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B.使用Y形管甲时,应将![]() 固体转移到浓硫酸中
固体转移到浓硫酸中
C.Y形管乙中产生的为氧化性气体,将![]() 氧化为
氧化为![]() 沉淀
沉淀
D.Y形管乙中的试剂可以分别是浓氨水和NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C.CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的各物质浓度数据如下:
aA(g)+bB(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A. 9∶3∶4B. 3∶1∶2C. 2∶1∶3D. 3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)=0.5mol/(L·s)B.υ(B)=0.3mol/(L·s)
C.υ(C)=0.8mol/(L·s)D.υ(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是![]() 种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
⑴滤渣的成分是________,反应②的离子方程式是________。
⑵干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ce(OH)4的数据如下表:
干法空气氧化法 | 氧化温度 | 氧化率 | 氧化时间 |
暴露空气中 | 110~120 | 90 | 18 |
在对流空气氧化炉中 | 110~120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
⑶利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3(如图):阳极电极反应式为________,离子交换膜为________(填“阴”或“阳”)离子交换膜。
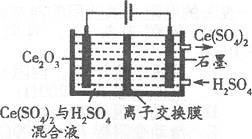
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com