
【题目】一种磁性材料的磨削废料(含镍质量分数约为21%)的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍的工艺流程如下:
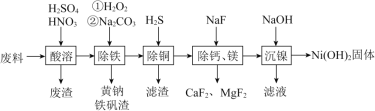
回答下列问题:
⑴合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应生成的气体只有N2。写出金属镍溶解的离子方程式:_______。
⑵“除铁”时H2O2的作用是__________,为了证明添加的H2O2已足量,应选择的试剂是__________(填“铁氰化钾”或“硫氰化钾”)溶液。
⑶“除铜”时,反应的离子方程式为__________,若用Na2S代替H2S除铜,优点是__________。
⑷已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是__________。
⑸镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M + Ni(OH)2![]() MH + NiOOH(式中M为储氢合金),写出电池放电过程中正极的电极反应式:__________。
MH + NiOOH(式中M为储氢合金),写出电池放电过程中正极的电极反应式:__________。
⑹已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组为测定黄钠铁矾的组成,进行了如下实验:
步骤Ⅰ.称取4.850g黄钠铁矾样品,加盐酸完全溶解后,配成100.00mL溶液A;
步骤Ⅱ.量取25.00mL溶液A,加入足量的KI,用0.2500 mol·L-1的Na2S2O3溶液进行滴定(反应为I2 + 2Na2S2O3 = 2NaI + Na2S4O6 ),滴定至终点时消耗30.00mL Na2S2O3溶液。
步骤Ⅲ![]() 另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
①用Na2S2O3溶液进行滴定时,使用的指示剂为__________,滴定达到终点时的颜色变化为__________。
②黄钠铁矾的化学式为 __________。
【答案】5Ni+12H++2NO3-= 5Ni2++N2↑+6H2O 将Fe2+氧化为Fe3+ 铁氰化钾 H2S+Cu2+=CuS↓+2H+ 无易挥发污染性气体H2S产生 过量的F-会生成氢氟酸腐蚀陶瓷容器 NiOOH + H2O + e-= Ni(OH)2 + OH- 淀粉溶液 当溶液蓝色恰好褪去,且半分钟内不再恢复 NaFe3(SO4)2(OH)6
【解析】
⑴已知Ni难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还边搅拌边缓慢加入了稀硝酸生成N2和Ni2+;
⑵H2O2具有氧化性,“除铁”时加入H2O2可将“酸溶”后溶液中的Fe2+氧化为Fe3+;为证明添加的H2O2已足量,主要验证亚铁离子反应完全,选择铁氰化钾溶液进行检验;
⑶据流程图可知,“除铜”时加入的沉淀剂为H2S,用Na2S代替H2S除铜,不产生易挥发污染性气体H2S;
⑷已知除杂过程在陶瓷容器中进行,除铜后的滤液应显酸性,若NaF的用量过大,过量的F-会生成氢氟酸腐蚀陶瓷容器;
⑸镍氢电池放电时,正极上NiOOH得电子发生还原反应,再写出电极反应式;
⑹①滴定过程中,有碘单质参与反应,故应选择淀粉溶液做指示剂;
②建立关系式先求出n(Fe3+),再根据沉淀得出硫酸根的物质的量,再求出m(Na+)+m(OH-)质量,根据化合价代数和为0可得,得n(Na+)、n(OH-),最后求出答案。
⑴已知Ni难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还边搅拌边缓慢加入了稀硝酸,反应有N2生成,则Ni溶解的离子方程式:5Ni+12H++2NO3-= 5Ni2++N2↑+6H2O;
故答案为:5Ni+12H++2NO3-= 5Ni2++N2↑+6H2O;
⑵H2O2具有氧化性,“除铁”时加入H2O2可将“酸溶”后溶液中的Fe2+氧化为Fe3+。为证明添加的H2O2已足量,可选择铁氰化钾溶液进行检验:若H2O2用量不足,溶液中残余的Fe2+会与铁氰化钾溶液反应产生蓝色沉淀;反之可说明H2O2足量;
故答案为:将Fe2+氧化为Fe3+;铁氰化钾;
⑶据流程图可知,“除铜”时加入的沉淀剂为H2S,对应的离子方程式为H2S+Cu2+=CuS↓ + 2H+;若用Na2S代替H2S除铜,不产生易挥发污染性气体H2S;
故答案为:H2S+Cu2+=CuS↓+2H+;不产生易挥发污染性气体H2S;
⑷已知除杂过程在陶瓷容器中进行,且据流程图可知除铜后的滤液应显酸性,所以若NaF的用量过大,过量的F-会生成氢氟酸腐蚀陶瓷容器;
故答案为:过量的F-会生成氢氟酸腐蚀陶瓷容器;
⑸镍氢电池放电时,正极上NiOOH得电子发生还原反应,电极反应式为NiOOH + H2O + e-= Ni(OH)2 + OH-;
故答案为:NiOOH + H2O + e-= Ni(OH)2 + OH-;
⑹①滴定过程中,有碘单质参与反应,故应选择淀粉溶液做指示剂;滴定达到终点时的颜色变化为:溶液蓝色恰好褪去,且半分钟内不再恢复;
故答案为:淀粉溶液;当溶液蓝色恰好褪去,且半分钟内不再恢复;
②加入足量的KI,反应为2Fe3++2I-= 2Fe2++I2,根据I2+2Na2S2O3=2NaI+Na2S4O6得出关系式为:Fe3+~Na2S2O3,则100.00mL中n(Fe3+)=0.25mol/L×0.03L×10 = 0.03mol;1.165g为硫酸钡,则100.00mL中![]() ,则y:m=3:2,m(Fe3+)+m(SO42-) =1.68g+1.92g = 3.6g,m(Na+)+m(OH-)=4.850g-3.6g=1.25g,根据化合价代数和为0可得,n(Na+)+n(OH-)=0.07mol,解得n(Na+)=0.01mol,n(OH-) =0.06mol,则x:y:m:n=1:3:2:6,故黄钠铁矾的化学式为NaFe3(SO4)2(OH)6;
,则y:m=3:2,m(Fe3+)+m(SO42-) =1.68g+1.92g = 3.6g,m(Na+)+m(OH-)=4.850g-3.6g=1.25g,根据化合价代数和为0可得,n(Na+)+n(OH-)=0.07mol,解得n(Na+)=0.01mol,n(OH-) =0.06mol,则x:y:m:n=1:3:2:6,故黄钠铁矾的化学式为NaFe3(SO4)2(OH)6;
故答案为:NaFe3(SO4)2(OH)6。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】以二氧化碳和氢气为原料制取乙醇的反应为2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
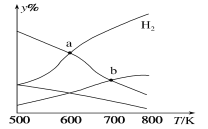
A.a点的平衡常数小于b点
B.b点,v正(CO2)=v逆(H2O)
C.a点,H2和H2O物质的量相等
D.其他条件恒定,充入更多H2,v(CO2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2![]() CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成NH3反应为放热反应,为提高NH3的产率,理论上应采取低温的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。
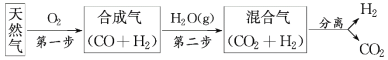
(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=____________。
(2)\在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数表达式为K=________
CH3OH(g)+H2O(g),,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数表达式为K=________
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
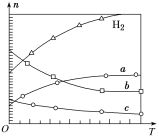
①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为________。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制备FeCO3,提取出的FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。已知:葡萄糖酸亚铁(C6H11O7)2Fe是常用的补铁剂,易溶于水。回答下列问题:
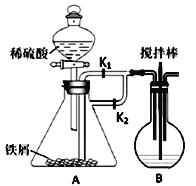
Ⅰ(1)B中加入药品Na2CO3,要使A中制得的FeSO4溶液进入B中发生反应,实验开始时,应打开分液漏斗的活塞、______,关闭______,一段时间后,关闭_______,打开________ (填旋塞的编号)。
(2)将葡萄糖酸与碳酸亚铁混合,反应的化学方程式为(有机物用分子式表示)________________。
(3)从环境保护的角度分析,该装置存在不足之处是:_____________。
Ⅱ.某补铁剂的主要成分是硫酸亚铁,用氧化还原滴定法可测定该补铁剂中铁元素的含量,实验的主要步骤如下:
①取10片补铁剂样品,溶解除去不溶物(不损耗铁元素),并配成100mL待测溶液。
②量取25.00mL待测液于锥形瓶中。
③用c mol·L1的酸性KMnO4溶液滴定至终点,记录消耗KMnO4溶液的体积,重复两次实验,平均消耗KMnO4溶液体积为V mL。
(4)该滴定原理的离子方程式为______________________
(5)上述实验中应该用稀硫酸酸化KMnO4溶液,如果用硝酸对KMnO4溶液进行酸化,对测定结果的影响是________(填“偏大”“偏小”或“无影响”)。滴定终点的实验现象为______。
(6)每片补铁剂含铁元素的质量为__________g(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实可用同一原理解释的是![]()
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.![]() 和
和![]() 溶液使酸性高锰酸钾的紫色褪去
溶液使酸性高锰酸钾的紫色褪去
C.漂白粉和水玻璃长期暴露在空气中变质
D.亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是( )
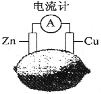
A.将电能转换为化学能
B.电子由铜片流出经导线到锌
C.一段时间后,锌片质量减轻
D.铜片一侧柠檬变蓝色,产生Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe元素在元素周期表中位于______区,基态Fe2+的离子结构示意图为_____________。
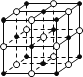
(2)氧化亚铁晶体的晶胞如下图所示。已知:氧化亚铁晶体的密度为ρg·cm-3(NA代表阿伏加德罗常数的值)。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2-的最短核间距为_____________cm。
(3)金属晶体Ti采取面心立方最密堆积,则Ti原子的空间利用率是 : ________π×100%(要求写出带根号的最简计算式)。
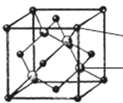
(4)SiC晶体的硬度为9.5,其晶胞结构如下图所示(小球代表C原子,大球代表Si原子);则该晶体类型为_________,在SiC晶体中,每个Si原子周围最近的C原子数目为________个;若晶胞的边长为a pm(NA代表阿伏加德罗常数的值),则该晶体的密度表达式为_______________g/cm3(化为最简形式 )。冰晶胞中水分子的空间排列方式与上述晶胞_______(填“相似”或“不相似”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置![]() 加持装置略去
加持装置略去![]() 能达到试验目的是( )
能达到试验目的是( )
选项 | A | B | C | D |
装置 |
|
|
|
|
实验目的 | 比较非金属性: N>C>Si | 制备并收集乙酸乙酯 | 除去Ca(OH)2与中的NH4Cl | 验证HCl的溶解性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com