
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(______、______)、稀硫酸、______、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。
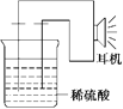
(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为____________,在耳机中又由__________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的________极,电极反应式为_____________,发生了________反应;
③铜钉应该接电流表的________极,电极反应式为_____________,发生了_________反应。
【答案】铁钉或铁条 铜钉(其他的惰性电极如铅笔芯、铂等都正确) 烧杯 导线 电能 电能 负 Fe-2e-=Fe2+ 氧化 正 2H++2e-=H2↑ 还原
【解析】
由反应Fe+2H+=Fe2++H2↑可知,反应中Fe被氧化,应为原电池的负极,则正极可为活泼性较铁弱的金属或非金属单质,结合形成原电池的条件以及能量的转化形式分析解答。
(2)由形成原电池的条件结合反应原理Fe+2H+=Fe2++H2↑可知,需要铁为负极,正极为铜钉(其他的惰性电极如铅笔 芯、铂等都可以),硫酸为电解质溶液,还需要烧杯、导线等,故答案为:铁钉或铁条;铜钉(其他的惰性电极如铅笔 芯、铂等都可以);烧杯;导线;
(4)①在原电池中,化学能转化为电能,在耳机中又由电能转化为声音这种能量,故答案为:电能;电能;
②在原电池中,铁为负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,如果将装置中的耳机改为电流计,铁钉应该接电流表的负极,电流表指针发生偏转,故答案为:负;Fe-2e-=Fe2+;氧化;
③根据②的分析,铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,应该接电流表的正极,故答案为:正;2H++2e-=H2↑;还原。


科目:高中化学 来源: 题型:
【题目】据最近的美国《农业研究》杂志报道,美国的科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式如图所示,则下列说法错误的是( )
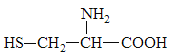
A.半胱氢酸是一种两性物质
B.两分子半胱氨酸,分子间脱去1个水分子形成的有机物结构简式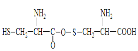
C.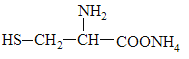 可与NaOH溶液反应放出一种碱性气体
可与NaOH溶液反应放出一种碱性气体
D.半胱氨酸属于α-氨基酸,可由某些蛋白质水解制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
A. 纯净的液氨中,pN=7
B. 液氨达到电离平衡时c(NH3)=c(NH4+)+c(NH2-)
C. 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D. 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是_______________________。
(2)铝与氢氧化钾溶液反应的离子方程式是______________。
(3)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是______________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因______________________。
③除去杂质后的氢氧化钾溶液从液体出口___________(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以粗盐和碳酸氢铵(![]() )为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为
)为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为![]() ;
;![]() ;
;![]() ;
;![]() 。
。
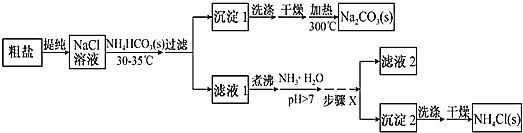
(1)粗盐中主要含有![]() 、
、![]() 、
、![]() 等杂质离子,粗盐提纯时使用的试剂有;①
等杂质离子,粗盐提纯时使用的试剂有;①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() ,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
A.①③④② B.①②④③ C.③②④① D.①②③④
(2)如何运用简单的方法判断粗盐中![]() 是否已除尽?__________。
是否已除尽?__________。
(3)从![]() 溶液到沉淀1的过程中,需蒸发浓缩。在加入固体
溶液到沉淀1的过程中,需蒸发浓缩。在加入固体![]() 之前进行蒸发浓缩优于在加入
之前进行蒸发浓缩优于在加入![]() 之后,原因是___________。
之后,原因是___________。
(4)写出沉淀1受热分解的化学方程式:_________。
(5)为提高![]() 产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
(6)某同学拟通过实验来测定该纯碱的纯度(假设杂质只含有![]() ),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的
),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的![]() 溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中
溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中![]() 的质量分数为____________。(用相关字母表示)
的质量分数为____________。(用相关字母表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(![]() )。碘酸钾和碘化钾在溶液中能发生如下反应:
)。碘酸钾和碘化钾在溶液中能发生如下反应:![]() 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )
A.该反应中氧化剂为![]() ,还原剂为
,还原剂为![]()
B.该反应中,每生成3mol![]() 时转移的电子数目为5NA
时转移的电子数目为5NA
C.上述反应中,氧化产物与还原产物的质量之比为1:5
D.直接向食盐中加入淀粉溶液,可以判断该食盐是否为加碘食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用泛的金属之一,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物![]() 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的![]() 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和![]() 的阴离子交换柱,使
的阴离子交换柱,使![]() 和
和![]() 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的![]() 用
用![]() 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出![]() 中x的值为_________(取整数)。
中x的值为_________(取整数)。
(2)在实验室中,FeCl2可用铁粉和_________反应制备,FeCl3可用铁粉和_________反应制备。现有一瓶FeCl2溶液,某同学欲检验该溶液是否已经变质,首先取适量溶液于洁净的试管中,然后向溶液中滴加几滴______________,观察溶液是否变成红色即可得出结论。
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:________;工业上还可以用FeCl3溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是____________。(填序号)。
A.若无固体剩余,则溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子
四种离子
B.若溶液中有![]() ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余
C.若有固体剩余,则溶液中一定有反应![]() 发生
发生
D.当溶液中有![]() 存在时,则一定没有
存在时,则一定没有![]() 析出
析出
(4)高铁酸钾(![]() )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在![]() 中铁元素的化合价为_________,
中铁元素的化合价为_________,![]() 与
与![]() 在强碱性条件下反应可制取
在强碱性条件下反应可制取![]() ,其反应的离子方程式为________。
,其反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

①浓H2SO4与Cu反应的化学方程式是____________________________________。
②试剂a是____________。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:__________。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________。
(3)根据沉淀F的存在,推测![]() 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,![]() 被氧化为
被氧化为![]() 进入D。
进入D。
实验三:探究![]() 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________:取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______。
②实验三的结论:__________。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和![]() 生成。
生成。
(6)根据上述实验所得结论:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
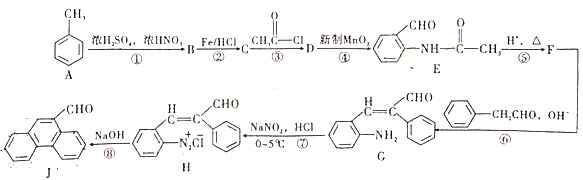
【题目】甲苯是重要的基础化工原料,下图是大学化学教材《有机化学基础》上由甲苯合成J的一种合成路线。
请依据上述流程回答以下问题
(1)B的化学名称为___________,J的分子式为___________。
(2)D生成E的反应类型为___________。
(3)设计第③步和第⑤步的目的是______________。
(4)由H生成J过程中生成的无机物除了![]() 外还有_________。
外还有_________。
(5)写出C→D的反应方程式为_______。
(6)D的同分异构体有多种。其中含有苯环和碳氧双键,且核磁共振氢谱有四组峰的有_________种。(不考虑立体异构)
(7)请依据流程图中相关信息,写出由甲苯和乙醛制备![]() 的合成路线________。(无机试剂任选)
的合成路线________。(无机试剂任选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com