
【题目】据最近的美国《农业研究》杂志报道,美国的科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式如图所示,则下列说法错误的是( )
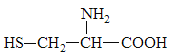
A.半胱氢酸是一种两性物质
B.两分子半胱氨酸,分子间脱去1个水分子形成的有机物结构简式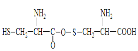
C.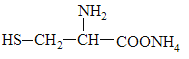 可与NaOH溶液反应放出一种碱性气体
可与NaOH溶液反应放出一种碱性气体
D.半胱氨酸属于α-氨基酸,可由某些蛋白质水解制取
【答案】B
【解析】
:
A.半胱氨酸含有氨基和羧基;
B.氨基酸之间可以进行脱水形成肽键,反应原理为羧基脱羟基氨基脱氢;
C.半胱氨酸在溶液中能电离出铵根离子;
D.α-氨基酸有一个H、一个-R、一个氨基和一个羧基是连接在同一个C原子上,因此就叫a-氨基酸;
A.半胱氨酸含有氨基和羧基,氨基显碱性,羧基显酸性,所以半胱氢酸是一种两性物质,A正确;
B.氨基酸之间可以进行脱水形成肽键,反应原理为羧基脱羟基氨基脱氢,B错误;
C.半胱氨酸在溶液中能电离出铵根离子,铵根和氢氧根生成氨气,C正确;
D.α-氨基酸有一个H、一个-R、一个氨基和一个羧基是连接在同一个C原子上,因此就叫a-氨基酸,因此半胱氢酸是α-氨基酸,蛋白质水解会生成氨基酸,D正确;
答案选B。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】对已达化学平衡的反应 2X(g)+Y(g)![]() 2Z(g) ΔH<0 下列说法正确的是
2Z(g) ΔH<0 下列说法正确的是
A.减小压强,逆反应速率增大,正反应速率减小,平衡向逆方向移动
B.升高温度,正、逆反应速率均增大,平衡向逆方向移动
C.除去部分的Z,正反应速率增大,逆反应速率减小,平衡向正方向移动
D.加入正催化剂,正、逆反应速率均增大,平衡向正方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+131.3 kJmol-1。
CO(g)+H2(g) ΔH=+131.3 kJmol-1。
①该反应在常温下____________自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是______________(填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为________________ 。(取小数二位,下同)
②该反应为 _____(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是________________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将少量SO2气体通入NaClO溶液中:SO2+2ClO—+H2O=SO32—+2HClO
B.惰性电极电解氯化镁溶液:2Cl—+2H2O ![]() Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH—
C.氯化铝溶液中滴加足量氨水:Al3++4OH—=AlO2—+2H2O
D.在氟化银溶液中滴入盐酸:Ag++F—+H++Cl—=AgCl↓+HF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压下1 mol A和n mol B在一个容积可变的容器中发生如下反应:
A(g)![]() 2B(g) + 2C(g),一段时间后达到平衡,生成a mol C。则下列说法中正确的是
2B(g) + 2C(g),一段时间后达到平衡,生成a mol C。则下列说法中正确的是
A.物质A、B的转化率之比一定是1∶2
B.若起始时放入3 mol A+3n mol B,则达平衡时生成3a mol C
C.起始时刻和达平衡后容器中的压强比为 (1+n)/(1+n-a/2)
D.当v正(A) =2v逆(C)时,可断定反应达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是( )
A.②④⑥B.①③④C.①③⑤⑥D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加 入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):aX(?) +2Y(?)![]() 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
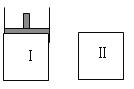
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。请回答下列问题:
(1)第一电离能介于B和N之间的第二周期的元素共有________种。
(2)基态K+离子电子占据最高能级的电子云轮廓图为_________形。
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下BeCl2以双聚分子存在,其结构式为________,其中Be原子的电子排布图为_________。
(4)四氟硼酸钠(NaBF4)是纺织工业的催化剂。其阴离子的中心原子的杂化轨道类型为_________。四氟硼酸钠中存在_______(填序号):
a. 氢键 b. 范德华力 c. 离子键 d. 配位键 e. σ键 f. π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(______、______)、稀硫酸、______、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。
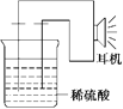
(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为____________,在耳机中又由__________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的________极,电极反应式为_____________,发生了________反应;
③铜钉应该接电流表的________极,电极反应式为_____________,发生了_________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com