
【题目】苯乙烯是石化行业的重要基础原料。能发生如下一系列变化。下列说法不正确的是
![]()
A. 有机物I能发生氧化反应、取代反应和加成反应
B. 有机物II能使溴的四氯化碳溶液褪色
C. 有机物Ⅲ的同分异构体中,苯环上只有一个烃基的物质不只4种
D. 上图反应①属于取代反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】《本草纲目》曾记载利尿剂甘汞(Hg2Cl2)制法:"用水银一两,白矾[KAl(SO4)2]二两,食盐一两,同研,不见星。铺于器内,以小乌盆覆之,筛灶灰,盐水和,封固盘口,以炭打二柱香取开,则粉升于盆上矣,其白如雪,轻盈可爱,一两汞可升粉八钱。”
(1)甘汞(Hg2Cl2)中化学键类型主要为___________.
(2)[KAl(SO4)2]所属物质类别为__________ (填标号)
A.酸式盐 B.复盐 C.正盐 D.混盐 E.硫酸盐
(3)文中“同研”涉及的操作,若在实验室通风橱内完成,则所需的仪器是_______。
(4)文中“则粉升于盆上矣”涉及的混合物分离方法是__________
(5)甘汞(Hg2Cl2)制备反应中,氧化剂与还原剂的物质的量之比为_________,该反应中还原产物是__________。
(6)已知文中一两等于十钱,则甘汞的产率约为________(保留三位有效数字)。
(7)由甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),该反应化学方程式为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 气体为直线型分子;B、C气体在标况下的密度均为1.25g/L;反应①②反应机理类似且原子利用率均为 100%;请回答下列问题:
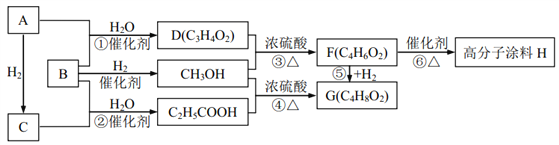
(1)D 中含有的官能团的名称为________________________;
(2)高分子涂料 H 的结构简式为________________________;
(3)下列说法正确的是(___)
A.鉴别有机物 A、 C 可以选用溴的四氯化碳溶液,褪色的是 A
B.反应⑤既是加成反应,又是还原反应,而且原子利用率为 100%
C.高分子涂料 H 含有碳碳双键,所以可以使酸性高锰酸钾溶液褪色
D.反应③④中浓硫酸的作用为催化剂和吸水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 22g N2O和CO2组成的混合气体中所含的氧原子总数为1.5NA
B. 0.1mol·L-1的氨水溶液中,NH3·H2O和NH4+的数目之和为0.1NA
C. 一定质量的Fe溶于稀硝酸中,当产生22.4L NO时,转移电子数为3NA
D. 常温下78g质量分数为26%的乙炔的苯溶液中,含有碳原子的数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院官微曾给出灰霾中细颗粒物的成因,部分分析如下图所示。


(1)根据如图信息可以看出,所列的气体污染物并非由机动车行驶造成的是______。汽车发动机废气稀燃控制系统主要工作原理如上右图所示;写出稀燃过程中NO发生的主要反应的方程式_____________________________________。
(2)农业活动排出的氨可能是施用的化肥分解,也可能是施用不当导致的。比如某些氮肥与碱性肥料混合施用会释出氨,用离子方程式解释________________________。
(3)经过研究发现我国的霾呈中性,其主要原因如下图所示,A的化学式是________。
2NH3(气)+SO2(气)+2NO2(气)![]() 2NH4+(溶液)+A(溶液)+2HONO(气)
2NH4+(溶液)+A(溶液)+2HONO(气)
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他极微量离子忽略不计):
离子 | Na+ | SO42- | NO3- | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.8×104 | 3.5×103 |
①NO和NaClO2溶液反应的离子方程式是___________________。
②表中y=_______。
(5)工业生产硝酸也有可能产生NOx污染。请写出硝酸生产中的第一步:氨的催化氧化的化学方程式___________________________________。若用氮气制氨的产率为90%,用氨生产硝酸时氨的催化氧化和氮氧化物转化为硝酸的损耗依次为5%、3%,1000 mol氮气可制___________mol硝酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图的虚线框中每一列、每一行相当于课本附录的元素周期表的每一族和每一周期,并已标出氢元素的位置,但它的列数和行数都多于元素周期表。请在虚线框中用实线画出周期表第一至第五周期的轮廓,并画出金属与非金属的分界线________。

(2)部分短周期主族元素的原子半径及主要化合价
元素 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 | 庚 | 辛 |
原子半径(nm) | 0.077 | 0.143 | 0.111 | 0.104 | 0.066 | 0.186 | 0.037 | 0.099 |
主要化合价 | +4,-4 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
①乙元素的原子结构示意图____________,丙在元素周期表中的位置___________,戊、庚、辛以原子个数比1∶1∶1形成的化合物的结构式______________。
②甲的单质与丁的最高价氧化物的水化物反应的化学方程式是___________,辛的单质与己的最高价氧化物的水化物反应的离子方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常温下部分短周期元素,最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,其中H的氧化物是两性氧化物。下列说法正确的是

A. 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大。
B. 根据图形分析可知,K、L两种元素最高价氧化物对应的水化物的酸性,前者较强。
C. 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同。
D. 元素K、H、G分别形成的简单离子的半径逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
(1) 与NF3分子互为等电子体的阴离子为________。
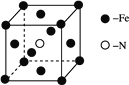
(2) 铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构见图。写出Fe3+的外围电子排布式:_____________,写出该反应的化学方程式:_____________。
(3) 维生素B4结构如图,则1 mol维生素B4分子中含有σ键的数目为________mol。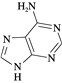
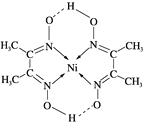
(4) 某配合物的结构如图,其中含有________(填序号);
a. 极性共价键 b. 非极性共价键 c. 配位键 d. 氢键
其中碳原子的杂化方式有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com