
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ(������������������ȥ)��A��C��E��G����ѧ��ѧ�г����ĵ��ʣ�ͨ��״���£�E���ܶ���С�����壬G�ǻ���ɫ�����壬B�dz�������ɫҺ�壬F��ǿ������ɫ��Ӧ����ʻ�ɫ��D��ij�־��д��ԵĽ����������Ҫ�ɷ֣�K���ȷֽ�����ɺ���ɫ���塣
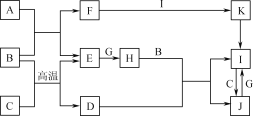
��ش��������⣺
(1) D�Ļ�ѧʽΪ____________��
(2) F�ĵ���ʽΪ____________��
(3) д��J��Һ�е���ϡ���ᷴӦ�����ӷ���ʽ��________________________��
(4) д��������G��F����Һ��Ӧ�Ļ�ѧ����ʽ��________________________��
���𰸡�Fe3O4 ![]() 3Fe2+��4H+��NO3-===3Fe3+��NO��+2H2O Cl2��2NaOH===NaCl��NaClO��H2O
3Fe2+��4H+��NO3-===3Fe3+��NO��+2H2O Cl2��2NaOH===NaCl��NaClO��H2O
��������
A��C��E��G����ѧ��ѧ�г����ĵ��ʣ�ͨ��״���£�E���ܶ���С�����壬Ϊ������G�ǻ���ɫ�����壬Ϊ������B�dz�������ɫҺ�壬Ϊˮ��F��ǿ������ɫ��Ӧ����ʻ�ɫ��Ϊ�������ƣ�D��ij�־��д��ԵĽ����������Ҫ�ɷ֣�Ϊ������������K���ȷֽ�����ɺ���ɫ���壬Ϊ������������AΪ�ơ�
E���ܶ���С�����壬Ϊ������G�ǻ���ɫ�����壬Ϊ������B�dz�������ɫҺ�壬Ϊˮ��F��ǿ������ɫ��Ӧ����ʻ�ɫ��Ϊ�������ƣ�D��ij�־��д��ԵĽ����������Ҫ�ɷ֣�Ϊ������������K���ȷֽ�����ɺ���ɫ���壬Ϊ������������AΪ�ƣ�CΪ����IΪ�Ȼ�����JΪ�Ȼ�������
(1) DΪ��������������ѧʽΪFe3O4��
(2) FΪ�������ƣ�����ʽΪ![]() ��
��
(3) �Ȼ���������ϡ���ᷴӦ�����������Ӻ�һ�����������ӷ���ʽ��3Fe2+��4H+��NO3-===3Fe3+��NO��+2H2O��
(4) �������������������Ʒ�Ӧ�����Ȼ��ƺʹ������ƺ�ˮ������ʽΪ��Cl2��2NaOH===NaCl��NaClO��H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڽ����к��ȵIJⶨʱ�����в���������ǣ� ��
A.��Ӧǰ�ᡢ����Һ���¶�Ҫ��ͬ
B.Ϊ��ʹ��Ӧ���Ƚ��У������ᣨ��зִμ����ᣩ
C.������Һ���¶ȼ�Ҫһֱ������Һ��
D.Ϊ��ʹ��Ӧ����ȫ������ʹ�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧһѡ��3:���ʽṹ�����ʣ�1735����仯ѧ�Ҳ�����(G��Brands)�Ƴ������ܡ��ܵĿ�����ܵĻ�����һֱ�����մɡ����������ŵ����ϡ���20���ͣ��ܼ���Ͻ��ڵ������е�����������պͺ���ȹ�ҵ���ŵõ��㷺��Ӧ�ã�����Ϊһ����Ҫ��ս�Խ����������ܼ��仯���������Ҫ���ã��ش���������:
(1)��̬Coԭ�ӵĵ����Ų�ʽΪ___________��
(2)[Co(NH3)5H2O]Cl3��һ��ש��ɫ�ľ��壬��ͨ��CoCl2��NH4Cl��Ũ��ˮ��H2O2�Ƶá�
��Co��N��0ԭ�ӵĵ�һ�������ɴ�С��˳����__________��
��[Co(NH3)5H2O]Cl3��CoԪ�ػ��ϼ�Ϊ____������λԭ��Ϊ_____��1mol�þ����к���____mol�Ҽ���
��H2O2��Oԭ�ӵ��ӻ����������______��H2O2����ˮ���ܣ������Ǽ��Է����⣬����Ϊ____��
��NH3��NF3�Ŀռ乹�Ͷ���ͬ,��Co3+����NH3�γ������ӣ���NF3���ܡ�ԭ����________��
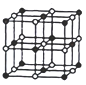
(3)CoO������ͼ����֪Coԭ�Ӱ뾶Ϊapm,Oԭ�Ӱ뾶Ϊbpm����Ⱦ����������Oԭ��Χ�ɵĿռ���״Ϊ_____���þ�����ԭ�ӵĿռ�������Ϊ__________(�ú�a��b�ļ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������Ԫ��Q��T��U��V��W��X��Y��Zԭ����������������֪��T��U��Vͬ���ڣ�W��X��Y��Zͬ���ڣ�U��Yͬ�壻Ԫ��Q��ij�ֺ���û�����ӣ�Ԫ��T���������������۵Ĵ�����Ϊ0��Q��U�γɵ���̬��������Է�������Ϊ17����ҵ��ͨ������Һ̬�������V�ĵ��ʣ��Ҹõ��ʵ�ij��ͬ���������DZ�������ر���������Ҫ���ϣ�W��X��Z������������Ӧ��ˮ��������֮�䶼�ܷ�Ӧ����W��X��Zԭ������������֮�͵���W��ԭ��������
(1)ZԪ��ԭ�ӵ� L�������Ϊ______��Ԫ�� Y��ԭ�ӽṹʾ��ͼ___________��T��һ�ֺ����ڿ���ʱ����������һЩ��������,�õĺ�����___________(����ط���)��
(2)Ԫ��Q��V�����γ�18���ӻ�����������ʽΪ_________��Ԫ��W��Q�γɵĻ����������_____________(�������ӻ��������������ۻ�������)��
(3)V���⻯���ͬ��������Ԫ�ص��⻯����۷е�����ƫ�ߣ�ԭ����___________��
(4)д��X��W ����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ�������ں���ɻ�����H2SO4��ҺΪ�������Һ�����ֵ�ص�ԭ��ͼ����ͼ��ʾ���ش��������⣺

��1���缫bΪ���__________������缫��ӦʽΪ___________ ����Ӧ����Ϊ________
��2�� ����·��ת��3mol����ʱ��a����________L��������״�������뷴Ӧ��
��3������ȼ�ϵ�ص��ŵ�____________����д���㣩��
��4������ȼ�ϵ���⣬���������о����õ�����أ����й��ڳ���ص�����������ȷ������______��
A������صĻ�ѧ��Ӧԭ����������ԭ��Ӧ
B�������ʹ�ŵ�ʱ��������ԭ��Ӧ�������
C������ؿ��������Ƶط�����硢�ŵ�
D���ϳ�ʱ�䲻ʹ�õ���ʱ����ôӵ�����ȡ����أ������ƴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ����, ��Ա��еĢ١�����Ԫ�أ���д���пհף�
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� |
(1)�ߵ����ӽṹʾ��ͼ��__________��
(2)��������õĽ�����________(��дԪ�ط���)�����γɵ����ȶ���̬�⻯��Ļ�ѧʽ��_______��
(3)
(4)�ݡ����γɻ������к��еĻ�ѧ����________(�������Ӽ����������ۼ���)��
(5)1mol�ܵĵ����������ڵ��⻯����ȫ��Ӧ�����������ڱ�״���µ����Ϊ_____��
(6)д���ĵ�����ܵ�����������ˮ������Һ��Ӧ�Ļ�ѧ����ʽ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�г�������ͼ����һ�����ֶ���������ͻ��ʵ��װ�õ�Ҫ�㣬����ز�����ѧ���̵�ԭ���� �����йػ�ѧͼ����ֵ�������ȷ����
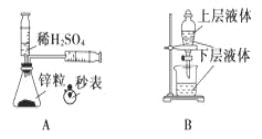
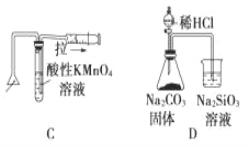
A. �ⶨһ��ʱ�������� H2 �ķ�Ӧ���� B. ��ȡ�����еĵ�
C. ������ȼ�ղ����� SO2 D. ֤���ǽ����ԣ�Cl>C>Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25 ��ʱ��CaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������������100 mL��CaSO4������Һ�У�����400 mL 0.01 mol��L��1��Na2SO4��Һ����Դ˹��̵�����������ȷ����(���Ի�Ϲ����е�����仯)
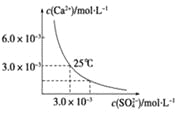
A. ��Һ������CaSO4������������Һ��c(SO42��)��ԭ����
B. ��Һ��������������Һ��c(Ca2��)��c(SO42��)����С
C. ��Һ������CaSO4��������Һ��c(Ca2��)��c(SO 42��)����С
D. ��Һ��������������������Һ��c(SO42��)��ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Cl2��˵���У�����ȷ����
A. Cl2��һ�ֻ���ɫ���ж����� B. �����Cl2�ɱ����ڸ�ƿ��
C. ��˿��Cl2��ȼ������FeCl3 D. ������Һ�������ֲ�ͬ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com