
����Ŀ������ȼ�ϵ�������ں���ɻ�����H2SO4��ҺΪ�������Һ�����ֵ�ص�ԭ��ͼ����ͼ��ʾ���ش��������⣺

��1���缫bΪ���__________������缫��ӦʽΪ___________ ����Ӧ����Ϊ________
��2�� ����·��ת��3mol����ʱ��a����________L��������״�������뷴Ӧ��
��3������ȼ�ϵ�ص��ŵ�____________����д���㣩��
��4������ȼ�ϵ���⣬���������о����õ�����أ����й��ڳ���ص�����������ȷ������______��
A������صĻ�ѧ��Ӧԭ����������ԭ��Ӧ
B�������ʹ�ŵ�ʱ��������ԭ��Ӧ�������
C������ؿ��������Ƶط�����硢�ŵ�
D���ϳ�ʱ�䲻ʹ�õ���ʱ����ôӵ�����ȡ����أ������ƴ��
���𰸡����� O2+4H++4e-=2H2O ��ԭ��Ӧ 33.6 Ч�ʸߣ������Ѻã�����ʱ������ C
��������
���⿼���������ȼ�ϵ�صĹ���ԭ����������ȼ�ϵ���У�ͨ��������һ��Ϊ��صĸ���������������Ӧ�������Ի����£��缫��ӦΪ��H22e=2H+�������������������õ��ӵĻ�ԭ��Ӧ�������Ի����£��缫��ӦΪ��O2+4H++4e=2H2O�����ӴӸ�����������������ܷ�Ӧ��������������ȼ�յĻ�ѧ����ʽһ�£�����ʱ���ܷ�ӦΪ2H2+O2�T2H2O���ݴ˽��
����ͼʾ��������ȼ�ϵ���У�ͨ��������һ��Ϊ��صĸ���������������Ӧ�������Ի����£��缫��ӦΪ��H22e=2H+�������������������õ��ӵĻ�ԭ��Ӧ�������Ի����£��缫��ӦΪ��O2+4H++4e=2H2O�����ӴӸ�����������������ܷ�Ӧ��������������ȼ�յĻ�ѧ����ʽһ�£�����ʱ���ܷ�ӦΪ2H2+O2�T2H2O��
��1��������������b��Ϊ����������ԭ��Ӧ���缫��ӦʽΪO2+4H++4e=2H2O����С���Ϊ��������O2+4H++4e=2H2O����ԭ��Ӧ��
��2��a���ĵ缫��ӦʽΪH22e=2H+�����������������ʵ���֮��Ϊ2:1������·��ת��3mol����ʱ��a����1.5mol�������뷴Ӧ������µ����Ϊ33.6L����С���Ϊ��33.6L��
��3������ȼ�ϵ�ص��ŵ�Ч�ʸߣ������Ѻã�����ʱ�����ȡ���С���Ϊ��Ч�ʸߣ������Ѻã�����ʱ�����ȡ�
��4��A. ��ŵ�Ļ�ѧ��Ӧ�е���ת�ƣ����Ա�����������ԭ��Ӧ����A��ȷ��
B.���ʱ��������������Ӧʽ�Ƿŵ�ʱ������������Ӧʽ���淴Ӧ�����Գ����ʹ�ŵ�ʱ��������ԭ��Ӧ������У���B��ȷ��
C. ����ص�ʹ����һ�����ޣ����Բ��������Ƶķ�����硢�ŵ磬��C����
D.�õ����ϳ�ʱ���ڲ���ʹ�ã���ý����ȡ�������ڵ��£�����ĵط����������������ʹ�õ������ص���ϵͳ�Ի�ʹ�����һ���͵��������������̵�ص�ʹ����������D��ȷ����ѡC��


 ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1934��������������(4He)���27Al�õ�һ����Ȼ���в����ڵ�P��һ��ͬλ������![]() P��������������ص��Ⱥӣ�
P��������������ص��Ⱥӣ�![]() Al��
Al��![]() He��
He��![]() P��
P��![]() n�������й�˵������ȷ����(����)
n�������й�˵������ȷ����(����)
A. �ñ仯˵��ԭ�Ӻ��ڻ�ѧ��Ӧ��Ҳ�ܷ����仯
B. �ñ仯��ѭ�����غ㶨��
C. ![]() n��һ�ֵ���������
n��һ�ֵ���������
D. ����30P��ԭ���������������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��A��B��C��D��E��Ԫ�����ڱ��е�λ����ͼ��ʾ��A�ļ����Ӱ뾶��ͬ����Ԫ�ؼ������а뾶��С�ġ���ش��������⣺

(1)����D��Ԫ�����ڱ��е�λ�ã�_____________________________��
(2)��A��B��C��E����Ԫ������������Ӧ��ˮ������������ǿ����__________(д��ѧʽ����ͬ)���ǽ��������̬�⻯����ȶ�����_____________________��
(3)д�����������������ӵĽṹʽ_________________________
������ԭ���������8�����ӣ� ��C��E��ɵĻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�Ĺ�ҵԭ�ϣ�����������ϳɵ��ʣ�ij���ʳ�������ˮ�е�Ԫ�ض���NH4+��NH3��H2O����ʽ���ڣ��÷�ˮ�Ĵ����������£�

��ش��������⣺
��1������1�м����������ƣ�д�����з��������ӷ���ʽ____________________
��2��д�������ӵĽṹʽ______��ָ�������л�ѧ����_____(�������Ӽ����������ۼ���)��
��3�����̢����������õ������£�NH4+����������Ӧ��������NO3-�����е�һ����Ӧ�������仯ʾ��ͼ��ͼ��
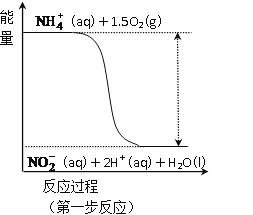
��һ����Ӧ��_______��Ӧ(ѡ��������������������)���ж�������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֱ���������ϡ���������������Һ��Ӧ����������Ӧ�ų�����������ͬ״����������ʱ����Ӧ�����ĵ�NaOH��HCl���ʵ���֮��Ϊ( )
A. 3: 1 B. 2:1 C. 1:1 D. 1:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
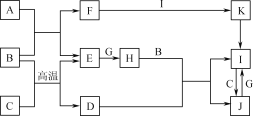
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ(������������������ȥ)��A��C��E��G����ѧ��ѧ�г����ĵ��ʣ�ͨ��״���£�E���ܶ���С�����壬G�ǻ���ɫ�����壬B�dz�������ɫҺ�壬F��ǿ������ɫ��Ӧ����ʻ�ɫ��D��ij�־��д��ԵĽ����������Ҫ�ɷ֣�K���ȷֽ�����ɺ���ɫ���塣
��ش��������⣺
(1) D�Ļ�ѧʽΪ____________��
(2) F�ĵ���ʽΪ____________��
(3) д��J��Һ�е���ϡ���ᷴӦ�����ӷ���ʽ��________________________��
(4) д��������G��F����Һ��Ӧ�Ļ�ѧ����ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ۺ����������ڽ�Լ��Դ������������ʵ�������÷Ͼɵ�ص�ͭñ(Cu��Zn�ܺ���ԼΪ99%)�Ʊ�ZnSO4��7H2O��CuSO4��5H2O�IJ���ʵ�鲽�����£�
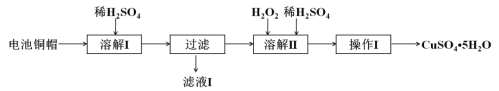
(1)�����ܽ�I�������У�Ϊ�ӿ��ܽ����ʣ��ɲ�ȡ�Ĵ�ʩ��___________��____________��
(2) ������ҺI������ȡZnSO4��7H2O��ʵ�鲽������Ϊ__________��__________�����ˡ���ˮϴ�ӡ����¸��
(3)�����ܽ�II�������У�������Ӧ�����ӷ���ʽΪ____________________________��
(4)Ϊ�ⶨ��Ʒ��CuSO4��5H2O�Ĵ��ȣ���ȡ1.270g��Ʒ������ϡ���Ტϡ����250mL��ȡ��25.00mL��Һ����ƿ�У����������KI��Һ��ַ�Ӧ������������μ���0.02000mol��L��1Na2S2O3��Һ���պ���ȫ��Ӧ������Na2S2O3��Һ25.00mL����֪��2Cu2��+4I��===2CuI(��ɫ)��+I2�� 2S2O32-+I2===2I��+S4O62- ������ʵ�����ݼ�����Ʒ��CuSO4��5H2O����������(д���������)_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г�������ʵ�����A��B��һ���¶��·�����ӦA(g)��xB(g)![]() 2C(g)���ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı䷴Ӧ��һ����������������и����ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯��ͼ��ʾ��
2C(g)���ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı䷴Ӧ��һ����������������и����ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯��ͼ��ʾ��


����˵������ȷ����
A. 30��40 min��÷�Ӧʹ���˴���
B. ��Ӧ����ʽ�е�x��1������ӦΪ���ȷ�Ӧ
C. 30 minʱ�����¶ȣ�40 minʱ�����¶�
D. 30 minʱ��Сѹǿ��40 minʱ�����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ſ�ѧ�����IJ��Ͻ������о����ʵ��ֶκ�;��Խ��Խ�࣬N5+��H3��O4��C60���ѱ����֡�����˵����ȷ���ǣ� ��
A.H2 �� H3 ����ͬ��������B.C60 ��Ħ������Ϊ 720 g
C.O2 �� O4 ����ͬλ��D.N5+�����к��� 36 ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com