
【题目】把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(g)+B(g) ![]() 2C(g)+xD(g);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol(Lmin)﹣1 . 下列说法中正确的是( )
2C(g)+xD(g);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol(Lmin)﹣1 . 下列说法中正确的是( )
A.A的平均反应速率为0.15mol(Lmin)﹣1
B.恒温下达到平衡的标志是C和D的生成速率相等
C.降低温度,逆反应速率变小,正反应速率增大,平衡正向移动
D.B的转化率为25%
【答案】A
【解析】解:A、v(C)= ![]() =0.1mol/(Lmin),v(A)=
=0.1mol/(Lmin),v(A)= ![]() v(C)=
v(C)= ![]() ×0.1mol/(Lmin)=0.15mol/(Lmin),故A正确;
×0.1mol/(Lmin)=0.15mol/(Lmin),故A正确;
B、C和D的生成速率都表示正反应速率,二者相等,不能说明反应达到平衡,故B错误;
C、降低温度,正逆反应速率都降低,该反应为放热反应,逆反应速率降低快,正反应速率降低慢,平衡向正反应移动,故C错误;
D、对于反应
3A(g)+ | B(g) |
| 2C(g)+ | xD(g) | |
起始: | 5mol | 0 | |||
转化: | 1mol | 2mol |
所以B的转化率为 ![]() ×100%=20%,故D错误.
×100%=20%,故D错误.
故选A.
A、根据C的物质的量,利用v= ![]() 计算v(C),再利用速率之比等于化学计量数之比计算v(A);
计算v(C),再利用速率之比等于化学计量数之比计算v(A);
B、可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
C、降低温度,正逆反应速率都降低,该反应为放热反应,逆反应速率降低快,正反应速率降低慢,平衡向正反应移动;
D、根据C的物质的量,利用方程式计算出参加反应的B的物质的量,再利用转化率定义计算.


科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进 行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能.下列有 关叙述正确的是( ) 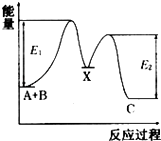
A.E2表示反应X→C的活化能
B.X是反应A十B→C的催化剂
C.反应A十B→C的△H<0
D.加入催化剂可改变反应A十B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为从海带中提取碘的工业生产过程,有关说法错误的是

A.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的说法中不正确的是
A. 自然界中的钠只以化合物的形式存在
B. 实验室剩余的钠需要放回原瓶
C. 钠的化学性质比较活泼,少量的钠可以保存在煤油中
D. 当钠与硫酸铜溶液反应时,有大量红色固体铜产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测,氨有望取代氢能,成为重要的新一代绿色能源.下列有关说法不正确的是( )
A.液氨作为清洁能源的反应原理是4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏
C.氨气比空气轻,标准状况下密度约为0.76 g?L﹣1
D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:Br<Fe2+。往100ml溴化亚铁溶液中缓慢通入2.24 L(标准状况)氯气,反应完成后溶液中有1/2的Br被氧化成Br2。则原溴化亚铁溶液的物质的量浓度为
A. 1.0mol/L B. 1.5mol/L C. 1.1mol/L D. 1.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅又称硅石,是制备硅及其化合物的重要原料.下列说法正确的是
A. SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B. 在高温条件下SiO2能与过量的碳反应生成SiC,体现了二氧化硅的氧化性
C. 高温下SiO2能与Na2CO3反应放出CO2,不能说明H2SiO3的酸性强于H2CO3
D. 二氧化硅溶于水显酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com