
【题目】根据下图所示装置和操作,回答下列有关问题。 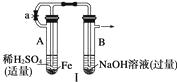
(1)按图Ⅰ所示装置,用两种不同的操作分别进行实验,观察B管中的现象。 ①操作1:先夹紧止水夹a,再使A管开始反应,实验中观察到B管中的现象是
。
②操作2:打开止水夹a,使A管反应一段时间后再夹紧止水夹a,实验中观察到B管
中的现象是。
③请说明造成两种操作现象不同的原因(如两种现象相同,此小题不用回答):
。
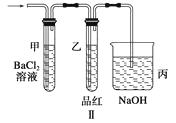
(2)上述装置实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后,再高温煅 烧(有关装置和操作均已略去),最后留下红色固体,将分解时产生的气体按图Ⅱ所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
① 用方程式表示试管甲产生白色沉淀的原因。
②根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生的化学反应方程式
。
③图Ⅱ中丙装置的作用是。
实验结束时,在装置丙中观察到的现象是。
【答案】
(1)液面升高且生成白色沉淀,且迅速变为灰绿色,最后变为红褐色;液面上升,有白色沉淀生成,且保持较长时间不变色;操作2中产生的H2将系统内空气赶尽,避免了Fe(OH)2的氧化
(2)O3+H2O+BaCl2===BaSO4↓+2HCl;2FeSO4 Fe2O3+SO3↑+SO2↑;吸收剩余的SO2气体;导管内倒吸一段液柱
【解析】由于Fe(OH)2极易被氧化为Fe(OH)3 , 溶液中溶解的O2就能把Fe(OH)2氧化。当夹紧a时,A试管便成了一个封闭体系,产生的H2使A试管内压强增大,将生成的FeSO4溶液压入B中,从而发生反应,有Fe(OH)2生成。而NaOH溶液中溶解的O2可将Fe(OH)2迅速氧化,最后转化成Fe(OH)3 , 所以,看到白色沉淀的时间很短。当进行操作2时,产生的H2首先通过导气管通入到B的NaOH溶液中,将其中溶解的O2赶走,再夹紧a时,FeSO4溶液压入B中,此时反应所产生的Fe(OH)2沉淀在一段时间内不变色;此题第二部分围绕FeSO4隔绝空气强热时的产物逆向推理,并利用已学过的氧化还原知识推断出FeSO4高温分解反应的化学方程式。


科目:高中化学 来源: 题型:
【题目】中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白: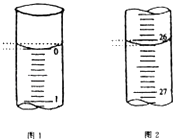
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是 . (写序号)
(2)选用的指示剂是 . (a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .
(7)滴定终点的判定依据是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,能使反应停止,可将试管从烧杯中取出(会有部分气体逸散)。下列气体的制取宜使用该装置的是 ( ) 
A.用二氧化锰(粉末)与双氧水制氧气
B.用锌粒与稀硫酸制氢气
C.用硫化亚铁(块状)与盐酸制硫化氢
D.用碳酸钙(块状)与稀硫酸制二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2的分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案设计实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
(1)实验①和②的目的是_________________________________。实验时由于没有观察到明显现象而无法得出结论。为了达到实验目的,你对原实验方案的改进措施是______________________________________________。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图所示。
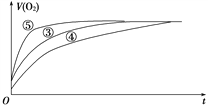
分析上图能够得出的实验结论是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在科学史上中国有许多重大的发明和发现,为世界现代物质文明奠定了基础。以下属于化学史上中国对世界重大贡献的是
①造纸 ②发现元素周期律 ③提出原子—分子论学说 ④指南针
⑤炼铜、炼铁、炼钢 ⑥提出化学元素的概念 ⑦人工合成牛胰岛素 ⑧火药
A. ①②③④ B. ②④⑦⑧ C. ①⑤⑦⑧ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得BeCl2为共价化合物,两个Be﹣Cl键间的夹角为180°,由此可判断BeCl2属于( )
A.由极性键形成的极性分子
B.由极性键形成的非极性分子
C.由非极性键形成的极性分子
D.由非极性键形成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气的制取及其性质的微型实验: ①用滤纸剪成四个适当大小的长方形,然后将这些滤纸都用凡士林粘在集气瓶内部。
②将饱和NaI、NaBr、Na2S、品红溶液(1~2滴)滴在如图所示的滤纸上。
③向集气瓶内加1.5 g KClO3 , 用滴管吸取约2 mL浓盐酸,然后将滴管装在双孔塞上,最后把该双孔塞塞在集气瓶上,如图所示。
④用滴管向漏斗中加NaOH溶液,注意所加NaOH溶液应以刚好装满漏斗下端的弯管处为宜(NaOH溶液在此起液封作用同时又有减压功能)
⑤挤压胶头滴管向集气瓶中加浓盐酸。
⑥整个现象看完后,用滴管向漏斗中加NaOH溶液吸收尾气。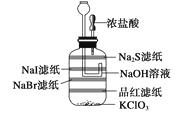
(1)该实验的主要现象: ;
(2)该实验的化学方程式:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,不会发生明显颜色变化的是
A. 氯化铜固体溶于水中 B. 硫酸铁溶液中滴加硫氰酸钾溶液
C. 氯化亚铁溶液中加入铜粉 D. 硫酸亚铁溶液中通入氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氯气的叙述中,不正确的是
A. 氯气可使湿润的红布条退色,所以氯气具有漂白性
B. 氯气可以使湿润的蓝色石蕊试纸先变红后褪色
C. 铜在氯气燃烧产生棕黄色的烟
D. 氯气是黄绿色的,氯离子是无色的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com